微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)已知下列热化学方程式:
①H2(g)+ O2(g)===H2O(l)ΔH=-285.8 kJ/mol
O2(g)===H2O(l)ΔH=-285.8 kJ/mol
②H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ/mol
O2(g)===H2O(g) ΔH=-241.8 kJ/mol
③C(s)+ O2(g)===CO(g)ΔH=-110.5 kJ/mol
O2(g)===CO(g)ΔH=-110.5 kJ/mol
④C(s)+O2(g)===CO2(g)ΔH=-393.5 kJ/mol
回答下列各问题:
(1)上述反应中属于放热反应的是 。
(2)C的燃烧热为 。
(3)CO的燃烧热为__________;其热化学方程式为__________________________。
参考答案:(1)①②③④ 。 (2)
本题解析:
试题解析:(1)在热化学方程式中吸热为正放热为负,属于放热反应的是①②③④;(2)根据燃烧热的定义,碳燃烧生成的两种氧化物中,二氧化碳更稳定,故其燃烧的热化学方程式为:C(s)+O2(g)
本题难度:一般
2、选择题 已知25℃、101kPa条件下:
4Al (s) + 3O2 (g)=2Al2O3 (s) △H=-2834.9 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H= -3119.91kJ/mol
由此得出的结论正确的是
A.等质量的O2比O3能量低,由O2变O3为放热反应
B.等质量的O2比O3能量低,由O2变O3 为吸热反应
C.3O2(g)=2O3 (g)△H=285.0 kJ/mol
D.O3比O2稳定,由O2变O3 为吸热反应
参考答案:BC
本题解析:
试题分析:4Al (s)+3O2(g)
本题难度:一般
3、选择题 已知:C(s)+O2(g)===CO2(g) ΔH1 CO2(g)+C(s)==="2CO(g)" ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A.ΔH1>0, ΔH3<0
B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3
D.ΔH3=ΔH4+ΔH5
参考答案:C
本题解析:
试题分析:C燃烧为放热反应故ΔH1<0故A项错误;CO燃烧放热故ΔH3<0,则B项错误;根据盖斯定律可知ΔH2=ΔH1—ΔH3,则ΔH1=ΔH2+ΔH3,故C项正确;ΔH5= ΔH3-
ΔH3- ΔH4,故D项错误。
ΔH4,故D项错误。
考点:反应能量变化及盖斯定律应用。
本题难度:一般
4、选择题 已知拆开1molH2中的化学键需要消耗436kJ能量,拆开1molO2中化学键需要消耗496kJ能量,形成水分子中1molH-O键释放463kJ能量,则下列热化学方程式正确的是( )
A.2H2+O2=2H2O△H=-484kJ?mol-1
B.2H2(g)+O2(g)=2H2O(l)△H=-484kJ?mol-1
C.2H2(g)+O2(g)=2H2O(g)△H=-484kJ?mol-1
D.2H2(g)+O2(g)=2H2O(g)△H=+484kJ?mol-1
参考答案:C
本题解析:
本题难度:简单
5、填空题 铝是最常见的金属之一。
(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是 。
(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
该反应的氧化剂为 。
(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=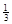 Na3AlH6 (s)+
Na3AlH6 (s)+ 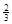 Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+" Al (s) +  H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1
则NaAlH4(s)=" NaH(s)" + Al (s) + H2(g) ΔH= 。
H2(g) ΔH= 。

(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式 存在。目前研究比较热门的Al-H2O2燃料电池,其原理如右图所示,电池总反应如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正极反应式为 。
②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的______倍。
③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为 。
参考答案:(9分)(1)常温下,铝易被浓硝酸、浓硫酸钝化
(2)
本题解析:
试题分析:(1)常温下,铝易被浓硝酸、浓硫酸钝化,所以浓硝酸、浓硫酸可贮存在铝制容器中。
(2)根据反应的方程式可知,铝元素的化合价从+3价降低到0价,得到电子,发生还原反应,所以氧化剂是LiAlH4、AlCl3 。
(3)根据盖斯定律可知,①+②×1/3,即得到反应式NaAlH4(s)=" NaH(s)" + Al (s) + H2(g),所以该反应的△H=+37 kJ/mol+70.5 kJ/mol÷3=+60.5 kJ/mol.
H2(g),所以该反应的△H=+37 kJ/mol+70.5 kJ/mol÷3=+60.5 kJ/mol.
(4)①原电池中正极得到电子,则根据总的反应式可知Al失去电子,做负极,所以正极反应式是3HO2-+3H2O+6e-=9OH-(或HO2-+H2O+2e-=3OH-)。
②普通锌锰干电池中负极是锌,65g锌失去2mol电子,而65g铝失去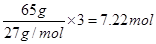 电子,所以Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的7.22÷2=3.6倍。
电子,所以Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的7.22÷2=3.6倍。
③铝能和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+6H2O+2OH-=2[Al(OH) 4]-+3H2↑。
考点:考查铝的性质、用途、反应热、电极反应式的书写以及有关计算
点评:该题是中等难度的试题,试题设计新颖,基础性强,有利于调动学生的学习兴趣和学习积极性,激发学生的学习求知欲,也有利于培养学生的规范答题能力和逻辑推理能力,提高学生的学习效率。
本题难度:困难