微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
A.Zn、Fe
B.Cu、Ag
C.Cu、Pt
D.Pt、Au
2、选择题 下列氧化还原反应方程式正确的是(???)
A.Fe2++Cl2====Fe3++2Cl-
B.Fe3++Fe====2Fe2+
C.2KMnO4+3H2O2+3H2SO4====K2SO4+2MnSO4+4O2↑+6H2O
D.2KMnO4+5H2O2+3H2SO4====K2SO4+2MnSO4+5O2↑+8H2O
3、选择题 有三种说法:①NH4NO3中氮元素显+5价;②4FeS2+11O2→2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等。这三种说法中错误的是????(???)?
A.只有①
B.只有②③
C.只有①③
D.①②③
4、填空题 (12分)(1)环境专家认为可以用金属铝将水体中的NO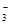 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH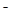 、Al(OH)3、NO
、Al(OH)3、NO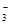 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。

该反应过程中,被氧化与被还原的元素的物质的量之比为???????????。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。电池正极的电极反应式为??????????;正极材料采用了铂网,利用铂网为正极的优点是????????。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g)?△H=-2834.9kJ/mol
Fe2O3(s)+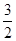 C(s)=
C(s)= 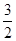 CO2(g)+2Fe(s)?△H=234.1kJ/mol
CO2(g)+2Fe(s)?△H=234.1kJ/mol
C(s)+O2(g)=CO2(g)?△H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式?????????????。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:

则反应过程中产生氢气的总体积为??????L(标准状况)。
5、填空题 (13分)NaBH4(硼氢化钠)是典型的离子化合物,在有机反应中可将醛、酮变为醇。
(1)硼氢化钠与水反应的离子方程式是BH4—+2H2O=BO2—+4H2↑,该反应中氧化剂是____________,生成1mol H2时转移电子的数目是_____________________。
(2)已知HBO2是弱酸,溶液的酸性对硼氢化钠与水的反应速率有影响,酸性越强,其反应速率越____,这是因为??????????????????????????????????????????????????。?
(3)硼氢化钠能把许多金属离子还原为金属单质,为抑制它与水的反应,反应在________? (填“酸性”“中性”或“碱性”)条件下进行,试完成并配平金离子(Au3+)被硼氢化钠还原的离子方程式:____Au3++____BH4—+__________=____Au↓+____BO2— +__________。