Vρ
(17V+22400)
参考答案:A、ρg/mL质量分数为ω氨水,其物质的量浓度c=
本题解析:
本题难度:简单
2、计算题 (8分)已知某饱和氯化钠溶液体积为VmL,溶液密度为d g·cm-3,溶质的质量分数为ω%,物质的量浓度为c mol·L-1,溶液中含NaCl的质量为m g。
(1)用ω表示该温度下NaCl的溶解度是????????????????????。
(2)用m、V表示溶液的物质的量浓度是????????????????????。
(3)用ω、d表示溶液的物质的量浓度是????????????????????。
(4)用c、d表示溶液中溶质的质量分数是????????????????????。
参考答案:(每空2分)(1) 本题解析:考查物质的量的有关计算。 本题解析:考查物质的量的有关计算。
(1)溶解度是在一定条件下,在100g水中溶解达到饱和时所能溶解的质量。由于饱和溶液中溶质的质量分数是ω%,所以溶解度S=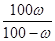 g。 g。
(2)溶液的体积是Vml,含有溶质氯化钠的质量是mg,物质的量是m/58.5mol,所以根据c=n/V可知,溶液的浓度是 本题难度:一般 本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B.25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA
C.在常温常压下,11.2 L Cl2含有的分子数为0.5 NA
D.标准状况下,11.2 L乙醇含有的分子数为0.5 NA
参考答案:B
本题解析:
试题分析:A、含有NA个氦原子的氦气在标准状况下的物质的量是1摩尔,体积约为22.4L,故A错误;B、64 g SO2的物质的量是1摩尔,含有3摩尔原子,含有的原子数为3NA,故B正确;C、不是标准状况下,无法计算氯气的物质的量,故C错误;D、标准状况下,乙醇不是气体,无法计算其物质的量,故D错误。故选B。
考点:阿伏伽德罗常数
本题难度:一般
4、计算题 将200mL稀硝酸与足量的铜粉在微热的条件下发生反应,经测定,生成了1.12LNO(标准状况)。试计算
(1)参加反应的铜的质量;
(2)该硝酸溶液中HNO3的物质的的量浓度;
参考答案:(1) 4.48 (2)1.0
本题解析:
试题分析:生成的NO是1.12L÷22.4L/mol=0.05mol
所以根据电子的得失守恒可知,消耗铜的质量是
生成硝酸铜的物质的量是0.075mol,则没有被还原的硝酸是0.075mol×2=0.15mol
被还原的硝酸是0.05mol
所以参加反应的硝酸是0.15mol+0
本题难度:一般
5、实验题 实验室要配制100mL 0.5mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,肯定不会用到的是___________
A.锥形瓶 B.200 mL容量瓶 C.量筒 D.胶头滴管 E.100 mL容量瓶 F.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品是__________________________。
(3)容量瓶上除有刻度线外还应标有__________________,容量瓶在使用前必须进行的一步操作是
_________________________。
(4)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是__________________
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液直接转入容量瓶后就进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算可得出可用托盘天平称取NaCl固体________克。若用4 mol/L的NaCl浓溶液配制100 mL
0.5 mol·L-1的稀溶液,应用量筒量取_________mL该浓溶液。
参考答案:(1)AB
(2)(小)烧杯、玻璃棒
(3)容
本题解析:
本题难度:一般
|