微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某学习小组在实验室模拟侯氏制碱法制备纯碱,其实验流程如下:
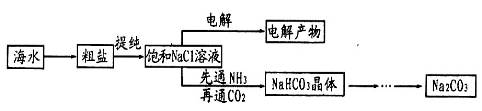
请回答下列问题:
(1)食盐溶液中含SO42-等杂质,不能用于除去SO42-的试剂是_________(填序号)。
a. Ba(OH)2???? b.Ba(NO3)2????? c. BaCl2?????? d. Na2CO3
(2)实验制备碳酸氢钠用到下列装置:

①实验装置中各接口的连接是d接____,e接_____,c接f。实验过程中先通入氨气的原因_____________。
②析出晶体后的溶液中含有大量的NH4+,检验NH4+的方法是__________________。
③瓶g内的溶液是___________________________________________。
(3)由碳酸氢钠制备纯碱的过程中用到的主要仪器除酒精灯、泥三角、三脚架、玻璃棒外,还有__________。
(4)用图电解饱和NaC1溶液的方法来制取NaOH、C12和H2。

①反应中生成的C12从_______(填“A”或“B”)放出,检验C12所用试剂(用品)______________________。
②经过长时间电解后,向电解液中滴加酚酞试液,发现溶液并未变红色,试分析可能的原因__________。
参考答案:(14分)(1)bd(2分) (2)①b? a(2分);氨气
本题解析:
试题分析:(1)由于在除杂时不能再引入新的杂质,所以要除去食盐溶液中含有SO42-等杂质,可以选择氢氧化钡或氯化钡,而不能选择硝酸钡或碳酸钡,答案选bd。
(2)①根据装置特点可知,A装置是制备碳酸氢钠的,B装置是制备CO2的,C装置是制备氨气的,D装置是吸收多余的氨气。由于氨气极易溶于水,所以氨气要通过a口通入到装置A中,所以正确连接顺序是d接b,e接a,c接f。由于氨气溶解度大,先通入氨气使溶液显碱性,增大CO2的吸收量,从而增大HCO3-的浓度,便于碳酸氢钠晶体析出。
②铵盐能和强碱反应生成氨气,可以通过检验氨气来检验NH4+,所以正确操作是取适量溶液于试管中,加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝。
③由于盐酸易挥发,所以生成的CO2中含有氯化氢,而氯化氢能和氨气反应,所以小于除去CO2中的氯化氢气体,因此瓶g内的溶液是饱和碳酸氢钠溶液。
(3)碳酸氢钠加热分解即生成碳酸钠,而固体加热需要在坩埚中进行,所以还缺少的仪器是坩埚和坩埚钳。
(4)①根据装置图可知,A和电源的负极相连,做阴极,溶液中的氢离子放电生成氢气。B和电源的正极相连,做阳极,溶液中的氯离子放电生成氯气,所以氯气在B电极生成。氯气具有强氧化性,能使湿润的淀粉碘化钾试纸变蓝色,据此可以检验氯气,因此检验C12所用试剂(用品)是淀粉碘化钾溶液或湿润的淀粉碘化钾试纸。
②由于电解生成的氯气会与NaOH充分反应,因此长时间电解后会导致电解最终产物仅是NaClO和H2。NaClO具有强氧化性,将酚酞氧化,故溶液不变红色。2和氨气的制备;仪器的选择;NH4+和氯气的检验;电解饱和食盐水的有关判断等
本题难度:困难
2、实验题 “套管实验”具有装置简洁便利等优点,结合下面的图示回答有关问题。

(1)欲利用图A比较碳酸氢钠和碳酸钠的热稳定性,并检验分解产物,最好应在大试管内底部加入 ____(填化学式),石灰水变浑浊的烧杯是 ___(填“甲”或“乙”)。
(2)欲利用图B验证铜与浓 硝酸的反应产物,该装置除简洁外,你认为最明显的一个优点是___。
(3)用锌粒和稀硫酸用图C仪器制取并收集一试管氢气,锌粒和稀硫酸应放在____(填“大”或 “小”)试管中组成发生装置,理由是____, 该反应的离子方程式为____。
参考答案:(1) Na2CO3 ;乙
(2)污染物未排入大气,
本题解析:
本题难度:一般
3、实验题 (10分)工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;?
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;?
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3?????? b.MnO2??????c.K2Cr2O7??
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3可制得重要的催化剂MnO2,MnCO3 → MnO2 + CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是????????kg。(摩尔质量/g·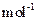 :MnCO3 115?? MnO2 87? MnO 71)
:MnCO3 115?? MnO2 87? MnO 71)
参考答案:(10分)(每空2分)
(1) b
(2) ?A
本题解析:(1)只能用双氧水来氧化,另外两种物质虽能氧化亚铁离子,但是又引入了新的杂质。
(5)MnCO3 → MnO2 + CO。MnCO3的物质的量为4000mol,如果产物全是MnO2,产物质量应为348.0Kg,因为有杂质MnO,产物质量为332.0Kg,MnO的物质的量为:
 ?。依据质量守恒,MnO2物质的量为3000mol,质量为261.0Kg。
?。依据质量守恒,MnO2物质的量为3000mol,质量为261.0Kg。
本题难度:一般
4、选择题 有四种无色溶液,它们分别是(NH4)2SO4、NH4Cl、Na2CO3、NaNO3,下列试剂中可以用来鉴别它们的是( )
A.BaCl2溶液
B.NaOH溶液
C.Ba(OH)2溶液
D.AgNO3溶液
参考答案:A.加入BaCl2溶液不能鉴别(NH4)2SO4和Na2CO
本题解析:
本题难度:一般
5、实验题 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
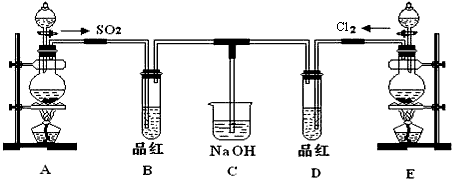
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:________________________________,D:____________________________。
(2)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)_____________________________________
(3)实验结束后,有同学认为装置C中会含有Na2SO4,如何验证Na2SO4是否存在________________??
参考答案:(1)①B:品红溶液褪色,D:品红溶液褪色。
②B:
本题解析:
本题难度:一般