微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为了比较氯和碘单质氧化性的强弱,可先制取氯气,并将氯气通入碘化钾淀粉溶液中,下图是本实验所需的仪器和药品。图中A、B、C、D、E、F分别表示玻璃导管或仪器接口。
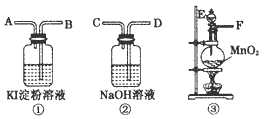
请回答下列问题:
(1)气体流向从左到右。实验前,上述各仪器装置的正确连接顺序是(填各接口的字母符号):分液漏斗从E处插入烧瓶后,____接____接____接____。
(2)写出制备Cl2的反应方程式___。某学生用含 0.4 mol HCl的浓盐酸和足量MnO2反应制Cl2,但得到的 Cl2总小于2.24 L(标准状况下),为什么?______ 。
(3)实验完成后,装置①中的溶液为____色,再向其中滴加足量NaOH溶液颜色能否褪去?____(填“能”或 “不能”),装置②中NaOH溶液的作用是_______。
(4)工业上,可用Cl2制备漂白粉,请写出制备漂白粉的离子方程式:____。
2、实验题 (8分)配制一定 物质的量浓度的NaOH溶液时,下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)
物质的量浓度的NaOH溶液时,下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)
(1)、用纸片连称量NaOH固体。? ____________;
(2)、向容量瓶加水定容后摇匀,发现液面低于刻度线,不采取任何措施。_________;
(3)有少量NaOH溶液残留在烧杯内。____________;
(4)向容量瓶加水时眼睛一直俯视液面。____________。
3、简答题 某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示.

已知:各离子开始沉淀及完全沉淀时的pH如下表所示.