微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某自来水中含有Ca2+、Mg2+、Na+、K+、、HCO32-、SO42-、Cl—,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据为:
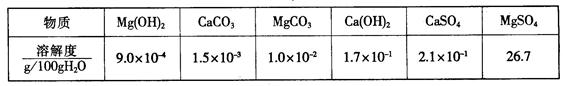
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:_________________________?????????????????????????????????????????????。
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是_____________ (填序号)。
A.食醋
B.氯化钡
C.碳酸钠
D.碳酸氢钠
(3)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应。现取含Ca2+浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00 mL,则该自来水样中Mg2+的物质的量浓度是______________________________。
参考答案:(1)Mg(HCO3)2 本题解析:(1)因为在加热的条件下碳酸氢镁会分解生成碳酸镁,继续加热,碳酸镁可以和水发生水解反应生成氢氧化镁。
本题解析:(1)因为在加热的条件下碳酸氢镁会分解生成碳酸镁,继续加热,碳酸镁可以和水发生水解反应生成氢氧化镁。
(2)钙的碳酸盐易溶于盐酸,所以可加入碳酸钠,生成碳酸钙而除去。
(3)10ml自来水中含有钙离子的物质的量是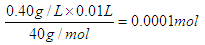 ,
,
同时消耗M也是0.0001mol。M总的物质的量是0.01mol.L×0.02
本题难度:一般
2、填空题 (12分)水泥是一种重要的建筑材料,水泥的强度是评价水泥质量的重要指标,它与水泥中CaO的含量有着良好的相关性,因此在特殊情况下可以通过测定其中Ca0的含量预测水泥的强度。为测量某品牌水泥中氧化钙的含量,进行如下实验:
步骤1:熔样:准确称取0.3000g试样置于坩埚中,高温灼烧5分钟后,冷却并研碎,加入2.000g无水碳酸钠混匀后,再高温灼烧10分钟。
步骤2:酸溶:取冷却后的烧结块,加入40mL水后,再加入l0mL稀盐酸和3滴稀硝酸。
步骤3:除杂:在酸溶后所得溶液中慢慢滴加稀氨水使其中的Fe3+、Al3+转化为沉淀,过滤。
步骤4:沉淀:在滤液中加入草酸铵溶液,加热煮沸后,边搅拌边滴加氨水至弱碱性,静置。
步骤5:溶解:将生成的草酸钙( CaC2O4)沉淀加入到稀硫酸中,加热并搅拌使其完全溶解。
步骤6:滴定:用0.1000 mol·L-1的KMnO4溶液进行滴定至微红色出现并保持30s不消失,共用去KMnO4溶液13.000mL。反应的化学方程式为:2 KMnO4+5 H2C2O4+3H2SO4= K2SO4+2MnSO4+5CO2↑+8H2O
(1)写出步骤3中Al3+转化为沉淀的离子方程式: ;
(2)已知室温下Al(OH)3的Ksp=1.0×10-33,欲使溶液中c(Al3+)≤l.0xl0-6mol·L-1,pH≥ ;
(3)通过计算确定该试样中氧化钙的质量分数(写出计算过程)。
参考答案:(1)Al3++3NH3?H2O=Al(OH)3↓+3NH4
本题解析:
试题分析:(1)稀氨水能与Al3+反应生成氢氧化铝沉淀和铵根离子:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(2)欲使溶液中c(Al3+)≤l.0×l0-6mol?L-1,C(OH-)≥ =
= =l.0×l0-9mol?L-1,
=l.0×l0-9mol?L-1,
c(H+)≥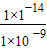 mol?L-1=l.0×l0-5mol?L-1,所以pH≥5,答案为:5.
mol?L-1=l.0×l0-5mol?L-1,所以pH≥5,答案为:5.
(3)5CaO~ 5CaC2O4 ~ 2KMnO4
5×56g 2mol
m(CaO) 0.1000mol?L-1×0.013L
 解得:m(CaO)=0.182g,氧化钙的质量分数为:
解得:m(CaO)=0.182g,氧化钙的质量分数为: ×100%=60.7%,答案为:氧化钙的质量分数为60.7%.
×100%=60.7%,答案为:氧化钙的质量分数为60.7%.
考点:考查沉淀溶解平衡的计算,利用化学方程式的计算等知识。
本题难度:困难
3、选择题 Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质
| Cu(OH)2
| Fe (OH)2
| Fe (OH)3
|
开始沉淀pH
| 4.2
| 5.8
| 1.2
|
完全沉淀pH
| 6.7
| 8.3
| 3.2
则在pH=4的溶液中能够大量共存的离子组是
A.Fe 3+、Cu2+、Cl-、NO3- B.Fe 2+、K+、SO42-、NO3-
C.Cu2+、Na+、CO32-、SO42- D.Fe 2+、K+、SO42-、Cl-
参考答案:D
本题解析:
试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。则A、根据表中数据可知,在pH=4时铁离子已经完全沉淀,则Fe 3+不能大量共存,A错误;B、pH=4溶液显酸性,在酸性溶液中Fe 2+与NO3-发生氧化还原反应而不能大量共存,B错误;C、Cu2+与CO32-在溶液中不能大量共存,C错误;D、Fe 2+、K+、SO42-、Cl-在pH=4的溶液中可以大量共存,D正确,答案选D。
考点:考查离子共存的正误判断
本题难度:一般
4、填空题 水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、
Pb(OH)3-、Pb(OH)42-。各形态的浓度分数α随溶液pH 变化的关系如图所示:【图中1表示Pb2+,2表示
Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-】
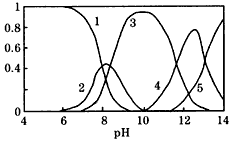
(1)往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子除H+、 Na+ 外还有__________,pH=9时,主要反应的离子方程式为_______________________。
(2)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
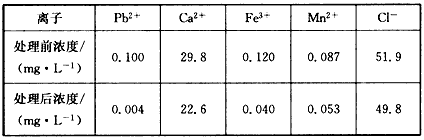
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是_________。
(3)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+ E2Pb(s) +2H+。则脱铅的最合适pH 范围为___(填代号)。 E2Pb(s) +2H+。则脱铅的最合适pH 范围为___(填代号)。
A.4 ~5
B.6 ~7
C.9~10
D.11~12
参考答案:(1)Pb2+、Pb(OH)+;Pb(OH)++OH-=Pb
本题解析:
本题难度:一般
5、选择题 已知在25℃时,Ksp(AgCl)=1.8×10—10,Ksp(AgI)=8.3×10—17,下列说法错误的是
A.在100mL0.01mol/LKCl溶液中,加入1mL0.01mol/LAgNO3溶液,有沉淀析出
B.往氯化银的悬浊液中加硝酸银,c(Cl—)、c(Ag+)均减小
C.由于Ksp(AgCl)>Ksp(AgI),AgCl沉淀在一定条件下可转化为AgI沉淀
D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度减小
参考答案:B
本题解析:
试题分析:在100mL0.01mol/LKCl溶液中,加入1mL0.01mol/LAgNO3溶液,Qc=0.01mol/Lx0.01mol/L=1x10-4mol/L>1.8×10—10,故有氯化银沉淀析出,A正确;往氯化银的悬浊液中加硝酸银,c(Cl—)减小、c(Ag+)增大,B错误;AgCl难溶,但是AgI溶解度更小,所以AgCl能转化为AgI;故C正确;加入氯化钠固体,氯离子浓度增大,是氯化银的沉淀溶解平衡向逆反应方向移动,故氯化银的溶解度降低,D正确,答案选B.
考点:沉淀溶解平衡
本题难度:一般
|