微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
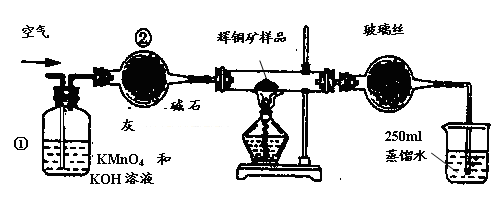
1、实验题 工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F. 移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为??????????????????????????????,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
滴定
次数
| 待测溶液的
体积/mL
| 标准溶液的体积
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 25.00
| 1.04
| 21.03
|
2
| 25.00
| 1.98
| 21.99
|
3
| 25.00
| 3.20
| 21.24
?
(4)本方案设计中由一个明显的缺陷影响了测定结果(不属于操作失误),你认为是????????????(写一种既可)。
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) =" 1" . 0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中c(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________。
参考答案:(1)除去空气中的还原性气体与酸性气体;?干燥空气
(
本题解析:
试题分析:(1)装置①溶液含有KMnO4具有氧化性,可吸收空气中的还原性气体,NaOH可吸收酸性气体;装置②含有碱石灰,具有吸水性,可干燥空气。
(2)操作F中KMnO4氧化H2SO4,配平可得化学方程式:2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O;滴定达到终点时,H2SO3完全反应,所以现象为:滴入最后一滴标准KMnO4溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色。
(3)三次滴定标准液的体积分别为:19.99mL、20.01mL、18.04mL
本题难度:一般
2、计算题 在ZnS沉淀中加入10mL0.001mol/L的CuSO4溶液是否有CuS沉淀生成?(必须写出判断理由)(已知:Ksp(ZnS)=1.6×10-24mol2/L2????????????Ksp(CuS)=1.3×10-36mol2/L2)
参考答案:[S2-]=[KSP(ZnS)]1/2=[1.6×10-24
本题解析:ZnS(s) Zn2+(aq)+S2-(aq),Ksp=c(Zn2+)c(S2-), Zn2+(aq)+S2-(aq),Ksp=c(Zn2+)c(S2-),
c(S2-)=[KSP(ZnS)]1/2=[1.6×10-24mol2/L2]1/2=1.61/2×10-12mol/L
CuS(s) 本题难度:一般 本题难度:一般
3、填空题 化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题:
 (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g) (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)
参考答案:
本题解析:
本题难度:困难
4、选择题 25℃,向50 mL 0.018 mol/L AgNO3 溶液中加入50 mL 0.02 mol/L 盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的体系中c(Ag+)为
A.1.8×10-7mol/L
B.1.8×10-8 mol/L
C.1.8×10-9mol/L
D.1.8×10-10mol/L
参考答案:A
本题解析:
试题分析:50 ml 0.02mol/L的盐酸中加入50ml 0.018mol/L AgNO3溶液加入后两者浓度分别变为c(Ag+)=0.018mol/L÷2=0.009 (mol/L)、c(Cl-)=0.02mol/L÷2=0.01(mol/L),因此反应后Cl-过量,过量的氯离子浓度=0.01mol/L-0.009mol/L=0.001mol/Lmol/L,因此根据溶度积常数 Ksp=c(Ag+)×C(Cl-)=1.8×10-10可知,溶液中c(Ag+)=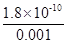 =1.8×10-7mol/L,答案选A。 =1.8×10-7mol/L,答案选A。
考点:考查溶度积常数的应用
本题难度:一般
5、选择题 在Ba(NO3)2、AgNO3、Cu(NO3)2溶液中分别滴入一种试剂都有沉淀产生.该试剂可能是( )
A.盐酸
B.硫酸
C.Na2CO3溶液
D.NaOH溶液
参考答案:A.加入盐酸,只生成AgCl沉淀,故A错误;
B.加入
本题解析:
本题难度:简单
|