微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 u常见化合价有+4和+6,硝酸铀酰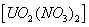 加热可发生如下分解:
加热可发生如下分解:
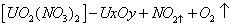 (未配平),将气体产物收集于试管中并倒扣于盛)水的水槽中,气体全部被吸收,水充满试管。则生成的铀的氧化物化学式是
(未配平),将气体产物收集于试管中并倒扣于盛)水的水槽中,气体全部被吸收,水充满试管。则生成的铀的氧化物化学式是
A.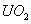
B.
C.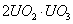
D.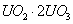
参考答案:B
本题解析:
试题分析:NO2和氧气溶于水,气体全部被吸收,水充满试管,这说明恰好生成硝酸。则在该分解反应中氮原子得到的电子全部来自于氧原子失去的电子,因此U的化合价是不变的,根据化学式可知,U的化合价是+6价,所以生成的铀的氧化物化学式是UO3,答案选B。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,在对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和逆向思维能力。该题的
本题难度:一般
2、选择题 火法炼铜首先要焙烧黄铜矿,反应为:CuFeS2+O2 Cu2S+FeS+SO2??则下列说法正确的是
Cu2S+FeS+SO2??则下列说法正确的是
A.CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原
B.每生成1molSO2转移6mol电子
C.SO2既是氧化产物又是还原产物,FeS只是还原产物
D.每转移1.2 mol电子,有0.3 mol氧气被还原
参考答案:B
本题解析:
试题分析:A.CuFeS2既是氧化剂又是还原剂,硫元素只被氧化。错误;B.根据反应过程中的元素的化合价的变化可知:每生成1molSO2转移6mol电子,正确;C.SO2既是氧化产物又是还原产物,FeS既不是氧化产物又不是还原产物,错误;D.根据方程式可知:每转移6mol的电子,有1mol的氧气反应,所以若转移1.2 mol电子,有0.2 mol氧气被还原,错误。
本题难度:一般
3、简答题 已知:①HSO3-的还原性比I-强,②IO3-+5I-+6H+=3I2+3H2O.工业上利用NaIO3和NaHSO3反应来制取单质I2.NaIO3来源于自然界的矿物,NaHSO3来源于硫酸工厂尾气处理的产物(用NaOH溶液吸收SO2).
(1)配平下列第②个反应,将系数填在横线上.
①NaIO3不足时,发生反应:2NaIO3+6NaHSO3=2NaI+3Na2SO4+3H2SO4
②NaIO3足量时,发生反应:______NaIO3+______NaHSO3=______I2+______Na2SO4+______H2SO4+______H2O
(2)现模拟工业制取I2.在含5molNaHSO3的溶液中逐滴加入NaIO3溶液.请画出加入NaIO3的物质的量和析出I2单质的物质的量的关系曲线.
(3)若工业上要生产2.54吨I2,至少需要处理标准状况下SO2的体积分数为0.224%的硫酸厂的尾气多少立方米?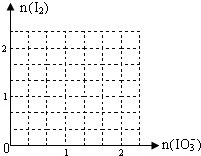
参考答案:(1)化学反应中碘元素化合价从+5价降为0价,生成1mol碘
本题解析:
本题难度:一般
4、计算题 维生素C又称抗坏血酸,广泛存在于水果、蔬菜中,属于外源性维生素,人体不能自身合成,必须从食物中摄取。其化学式为C6H8O6,相对分子量为176.1,由于分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,半反应为:
C6H8O6=C6H6O6+2H++2e???jy=0.18V
因此,可以采用碘量法测定维生素C药片中抗坏血酸的含量。具体实验步骤及结果如下:
(1)准确移取0.01667mol/L的K2Cr2O7标准溶液10.00mL于碘量瓶中,加3mol/L H2SO4溶液10mL,10% KI溶液10mL,塞上瓶塞,暗处放置反应5min,加入100mL水稀释,用Na2S2O3标准溶液滴定至淡黄色时,加入2mL淀粉溶液,继续滴定至溶液由蓝色变为亮绿色。平行三次实验,消耗Na2S2O3标准溶液平均体积为19.76mL。
(2)准确移取上述Na2S2O3标准溶液10.00mL于锥瓶中,加水50mL,淀粉溶液2mL,用I2标准溶液滴定至蓝色且30s不褪。平行三次实验,消耗I2标准溶液平均体积为10.15mL。
(3)准确称取0.2205g的维生素C粉末(维生素C药片研细所得)于锥瓶中,加新煮沸过并冷却的蒸馏水100mL,2 mol/L HAc溶液10mL,淀粉溶液2mL,立即用I2标准溶液滴定至蓝色且30s不褪,消耗12.50mL。
(4)重复操作步骤(3),称取维生素C粉末0.2176g,消耗I2标准溶液为12.36mL;称取维生素C粉末0.2332g,消耗I2标准溶液为13.21mL。
根据以上实验结果计算出该维生素C药片中所含抗坏血酸的质量分数。
参考答案:计算过程:先计算出Na2S2O3标准溶液的浓度;然后用Na2
本题解析:本题所涉及的所有反应均为氧化还原反应,因此滴定的类型为氧化还原滴定。不过在标准溶液的标定(如Na2S2O3、I2水溶液),以及维生素C的滴定过程中,滴定的方式是有区别的。步骤⑴和步骤⑵是标准溶液的标定,其中步骤⑴是置换滴定的方式,即:
Cr2O72- ~ 3I2 ~ 6S2O32-
0.01667mol/L ×10.00mL c(S2O32-)×19.76mL
而I2标准溶液采用的是直接滴定,即
I2????????????????~???????? 2S2O32-
本题难度:一般
5、简答题 某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI
(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目:______;
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应向逆反应方向进行,此时体系中的氧化反应为由______→______.如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是______;
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关.下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号)______.
①Cu与HNO3溶液??②Cu与FeCl3溶液??③Fe与HCl溶液??④Zn与H2SO4溶液.
参考答案:(1)当元素处于最高价时只有氧化性,所以Na3AsO4在反应
本题解析:
本题难度:一般