微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质属于电解质的一组是
A.CO2、SO2、HCl
B.H2SO4、K2O、BaSO4
C.H3PO4、H2O、Cu
D.NH3、CH4、NaCl
参考答案:B
本题解析:分析:电解质是在水溶液或熔融状态下能导电的化合物.
解答:A.CO2、SO2属于非电解质,故A错误;
B.H2SO4、K2O、BaSO4是水溶液状态下能导电的化合物,属于电解质,故B正确;
C.铜是单质,不是化合物,所以不是电解质,故C错误;
D.NH3、CH4属于非电解质,故D错误.
故选B.
点评:本题考查学生电解质的概念,难度不大,注意溶于水溶液中或在熔融状态下就能够导电,即是以离子的形式分散在水中,二是该物质是化合物.
本题难度:困难
2、选择题 体积相同、pH值相同的HCl溶液和CH3COOH溶液,与NaOH溶液完全反应时两者消耗NaOH的物质的量
A.中和HCI的多
B.中和CH3COOH的多
C.相同
D.无法比较
参考答案:B
本题解析:
试题分析:本题考查强弱电解质的比较,抓住强电解质溶于水全部电离,弱电解质溶于水部分电离进行相关分析。HCl为强电解质,溶于水全部电离,CH3COOH为弱电解质,溶于水部分电离,pH值相同的HCl溶液和CH3COOH溶液,醋酸的浓度大,等体积时醋酸的物质的量大,与NaOH溶液反应时,醋酸消耗NaOH多,选B。
本题难度:简单
3、填空题 为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:
0.010 mol·L-1氨水、0.1 mol·L-1 NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确? (填“正确”或“不正确”),并说明理由 。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b应满足什么关系? 。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入少量NH4Cl晶体,溶液颜色变 (填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质? (填“能”或“否”),并说明原因 。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质: 。
参考答案:(1)正确 若是强电解质,则0.010 mol·L-1氨水中
本题解析:(1)若NH3·H2O是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12。用pH试纸测出0.010 mol·L-1氨水的pH为10,说明NH3·H2O没有完全电离,应为弱电解质。
(2)若NH3·H2O是强电解质,用蒸馏水稀释至1 000 mL,其pH=a-2。因为NH3·H2O是弱电解质,不能完全电离,a、b应满足a-2<b<a。
(3)向0.010 mol·L-1氨水中加入少量NH4Cl晶体,有两种可能:一是氯化铵在水溶液中电离出的NH4+水解使溶液显酸性,加入氨水中使其pH降低;二是NH4+使NH3·H2O的电离平衡NH3·H2O NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均会使溶液颜色变浅,可证明NH3·H2O是弱电解质。
NH4++OH-逆向移动,从而使溶液的pH降低。这两种可能均会使溶液颜色变浅,可证明NH3·H2O是弱电解质。
(4)NH4Cl为强酸弱碱盐,只需检验NH4Cl溶液的酸碱性,即可证明NH3·H2O是弱电解质,还是强电解质。
本题难度:一般
4、填空题 (10分) 25℃时,电离平衡常数:
化学式
| CH3COOH
| H2CO3
| HClO
| H2C4H4O6(酒石酸)
| H2SO3
|
电离平衡常数
| 2.0×10-5
| K1=4.3×10-7
K2=5.6×10-11
| 3.0×10-8
| K1=9.1×10-4
K2=4.3×10-5
| K1=1.3×10-2
K2=6.3×10-8
回答下列问题:
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,e.Na2C4H4O6;物质的量浓度由大到小的顺序是 (填字母)。
(2)常温下,0.1mol/L的CH3COOH溶液的pH== (已知lg2=0.3)。
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-)>c(ClO-) > c(H+)
C.c(Na+) ==" c(HClO)" +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)== c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)== c(OH-) + c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式 。
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)= 。(用准确的数值表示)
参考答案:(1) e c d b a (2)2.85(2分
本题解析:
试题分析:(1)分析题给电离平衡常数知,酸性:HC4H4O6—>CH3COOH> H2CO3>HClO> HCO3—,根据盐类水解规律:形成盐的酸根对应酸越弱,该盐的水解程度越大,同浓度溶液的碱性越强,PH越大,可知,物质的量浓度相同这五种盐溶液的PH:Na2CO3>NaClO >NaHCO3>CH3COONa> Na2C4H4O6,则pH相同的五种盐溶液的物质的量浓度:Na2CO3<NaClO <NaHCO3<CH3COONa< Na2C4H4O6,由大到小的顺序是e c d b a;(2)设0.1mol/L的CH3COOH溶液中氢离子浓度为x,代入醋酸的电离常数表达式得:x2/0.1=2.0×10-5,解得x=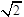 ×10-3,PH=2.85;(3)根据题给信息知,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,发生的反应为: ×10-3,PH=2.85;(3)根据题给信息知,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,发生的反应为:
HClO+ Na2CO3= NaClO+ NaHCO3,所得溶液为浓度均为0.05mol/L的NaClO和 NaHCO3的混合液,A、ClO-的水解程度大于HCO3-,则c(HCO3-) >c(ClO-) ,错误;B、c(Na+) > c(HCO3-) >c(ClO-) > c(H+),正确;C、根据物料守恒知,c(Na+)="c(HClO)" +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-),正确;D、根据电荷守恒知,c(Na+) + c(H+)= c(ClO-)+ c(HCO3-) + 2c(CO32-)+ c(OH-),错误;E、根据物料守恒和电荷守恒知,c(HClO) + c(H+)+ c(H2CO3)= c(OH-) + c(CO32-),正确;选BCE;(4)根据题意知H2CO3>HClO> HCO3—,少量的CO2通入NaClO溶液中的化学方程式为CO2+ NaClO+ H2O= NaHCO3+ HClO;(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液为0.05mol/L的NaHC4H4O6,根据电荷守恒式可知,c(HC4H4O6-)+2 c(C4H4O62-)= c(Na+) + c(H+) —c(OH-)= (0.05+10-6-10-8)mol/L ="0.05000099" mol/L。
考点:考查电解质溶液,涉及弱电解质的电离和盐类的水解。
本题难度:困难
5、选择题 pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m和n倍,稀释后两溶液pH仍相同,则m和n的关系是 [???? ]
A.m=n
B.m>n
C.m<n
D.无法判断
参考答案:B
本题解析:
本题难度:一般
|