微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)根据所学化学反应原理填空:
(1)升高温度时,水的pH????????(填“增大”“减小”或“不变”)
(2)体积、pH均相同的盐酸和醋酸溶液,中和等浓度的NaOH溶液时所需体积分别为V1、V2 。则V1???????V2(填“<”、“>”或“=”)
(3)某反应放热且熵增加,该反应?????????自发进行(用“能”或“不能”表示)
参考答案:(6分)(1)减小? (2)?<?? (3)?能
本题解析:(1)电离是吸热的,所以升高温度,促进水的电离,氢离子浓度增大,pH减小。
(2)醋酸是弱电解质,在pH相同的条件下,醋酸的浓度大于盐酸的,所以醋酸消耗的氢氧化钠多。
本题难度:一般
2、选择题 常温时,将V1mL c1 mol/L的氨水滴加到 V2mL c2 mol/L 的盐酸中,则
小题1:若混合溶液的pH=7,则 c1V1??????c2V2; c(NH4+) ????????c(Cl-)(填>、=或<,下同)
小题2:若混合溶液的pH>7,则c1V1??????c2V2; c(NH4+) ????????c(Cl-)
小题3:若V1=V2、c1= c2,则混合溶液中离子浓度的大小关系为????????????。若此时溶液的pH=a,则由水电离出来的H+的浓度_________ mol·L-1,并写出下列算式的数学表达式: c(Cl-)—c(NH4+)=________________ mol·L-1
小题4:若V1=V2,且混合溶液的pH<7,则一定有c1< c2吗?请说明理由?????。
参考答案:
小题1:? >?? =
小题2:? &
本题解析:考查酸碱中和的有关计算以及溶液中离子浓度大小关系的比较。
小题1:氨水是弱碱,若氨水和盐酸恰好反应,生成物氯化铵水解,溶液显酸性。若溶液显中性,则说明氨水过量,即c1V1>c2V2。根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知,当溶液显中性 即c(H+)=c(OH-)时,c(NH4+)=c(Cl-)。
小题2:若混合溶液的pH>7
本题难度:一般
3、选择题 已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
参考答案:B
本题解析:
本题难度:一般
4、选择题 已知下面三个数据:7.2×10-4、4.6×10-4、 4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生: NaCN+ HNO2==HCN+NaNO2?? NaCN + HF==HCN+NaF? ?NaNO2 + HF=HNO2 +NaF 由此可判断下列叙述不正确的是
A.K(HF) =7.2×10-4
B.K(HNO2) =4.9×10-1
C.根据其中两个反应即可得出三种酸的强弱顺序为:HF> HNO2>HCN
D.K(HCN)
参考答案:B
本题解析:
本题难度:一般
5、填空题 已经知25℃时几种物质的电离度(溶液浓度为0.1mol)如下表:

(已知(H2SO4的第一步是完全电离的)
(1)25℃时,0.1mol/L上述几种溶液[H+]由大到小的顺序是(填序号)____;
(2)25℃时,pH值相同的上述几种溶液,其物质的量浓度由大到小的顺序是____;
(3)25℃时,将足量的 Zn粉放入等体积、pH=1的上述几种溶液中产生氢气的体积(同温同压下),由大到小顺序为____;
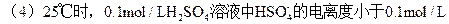

参考答案:(1)①④②③
(2)③②④①
(3)③②①④<
本题解析:(1)对上述四种溶液,均为0.1mol/L时,H2SO4=H++HSO4-,HSO4-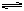 H++SO42-,所以其[H+]=0.1+0.1×10%=0.11(mol/L),NaHSO4中的[H+]=0.1×0.29=0.029mol/L,CH3COOH中的[H+]=0.1×0.0133=1.33×10-3mol/L
H++SO42-,所以其[H+]=0.1+0.1×10%=0.11(mol/L),NaHSO4中的[H+]=0.1×0.29=0.029mol/L,CH3COOH中的[H+]=0.1×0.0133=1.33×10-3mol/L
本题难度:一般