微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列图像表达正确的是? (??? )


A.图①表示25 ℃时,用0.1 mol/L盐酸滴定20 mL 0.1mol/L氨水
B.图②表示常温下,等量锌粉分别与两份足量的等体积等浓度的盐酸反应
C.图③表示向CaCl2溶液中通入CO2
D.图④表示向醋酸溶液中滴入氨水
参考答案:D
本题解析:
试题分析:A.因为氨水为弱碱,20mL 0.1mol/L氨水的PH小于13.
 B.Zn与HCl的反应方程式为Zn+2HCl
B.Zn与HCl的反应方程式为Zn+2HCl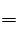 本题难度:简单
本题难度:简单
2、选择题 下列比较中,正确的是
A.同温度同物质的量浓度时,HF比HCN易电离,则等浓度等体积的NaF溶液比 NaCN 溶液中阴子总数少
B.0.2 mol?L-l NH4Cl 和 0.l mol?L-l NaOH 溶液等体积混合后:c (Cl-) > c(NH4+)> c (Na+) > c (OH-) >c (H+)
C.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
D.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>④>③[来源:学科网]
参考答案:B
本题解析:
试题分析:A、酸性:HF>HCN,故等浓度的NaF溶液中氟离子的水解程度比 NaCN 溶液中CN-的水解程度小,溶液的碱性弱,但二者水解均产生氢氧根,则等浓度等体积的NaF溶液和 NaCN 溶液中阴子总数相等,错误;B、0.2 mol?L-l NH4Cl 和 0.l mol?L-l NaOH 溶液等体积混合后所得溶液为等浓度的氯化铵、氯化钠和一水合氨的混合液,溶液呈碱性,一水合氨的电离程度大于铵离子的水解程度,离子浓度大小关系为:c (Cl-) > c(NH4+)> c (Na+) > c (OH-) >c (H+),正确;C、0.1 mol/L的NaHB溶液pH为4说明HB-的电离程度大于其水解程度,又电离和水解都是微弱的,则有:c(HB-) >c(B2-) >c(H2B),错误;D.氨水中的 NH4+来自弱电解质NH3·H2O的电离,弱电解质的电离的电离是微弱的,其余三者中NH4+来自强电解质盐的电离,铵离子的水解微弱,故相同物质的量浓度的四种溶液中, NH3·H2O中c(NH4+) 最小,错误。
考点:考查离子浓度大小比较。
本题难度:困难
3、选择题 将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。如把含H2S的空气通入CuSO4溶液,导电性变化不大但溶液吸收H2S的容量大;若用溴水,则吸收容量不大而导电性变化大。现要测量空气中的含氯量,并兼顾容量和导电性变化的灵敏度,最理想的吸收溶液是(??)
A.NaOH溶液?
B.蒸馏水?
C.Na2SO3溶液?
D.KI溶液)
参考答案:C
本题解析:本题错解之一是由于思维定势,对液体吸收气体容量大简单地理解为溶解度较大。常温下氯气在水中的溶解度为1∶2,属于可溶范围,符合吸收容量大的条件;再考虑氯气溶于水生成盐酸和次氯酸的导电性比蒸馏水大大增强,灵敏度也好。因此,选择了B选项。实际上气体的溶解度表示的是在1L水中溶解的气体体积数,而相同物质的量的气体和液体、固体在体积上相差一千倍左右,如1mol任何气体在标准状况下的体积为22.4L;1mol水18 mL。若1L溶液中含有1mol溶质,它吸收1mol的气体(22.4L),比溶解的气体多得多,何况溶质的
本题难度:简单
4、选择题 由下列实验事实得出的结论正确的是[???? ]
实验事实
结论
A.
Cl2的水溶液可以导电
Cl2是弱电解质
B.
将SO2通入Ba(NO3)2溶液,有白色沉淀生成
BaSO3难溶于硝酸
C.
C6H5ONa溶液中通CO2气体出现浑浊
酸性:C6H5OH<H2CO3
D.
常温下白磷可自燃而氮气须在放电时才与氧气反应
非金属性:P>N
参考答案:C
本题解析:
本题难度:一般
5、填空题 (1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示95 ℃时水的电离达平衡时的离子浓度。则95℃时0.1 mol·L-1的NaOH溶液中,由水电离出的 c(H+)=??????????mol·L-1,Kw(25 ℃)??????????Kw(95℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl 固体,对水的电离平衡的影响是??????????(填“促进”、“抑制”或“不影响”)。

(2)25℃时,在0.1L 0.2 mol·L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH=???????????,电离度为?????????????。
(3)电离平衡常数是衡量弱电解质电离程度强弱的量(已知如表数据)。向NaCN溶液中通入少量CO2,所发生反应的化学方程式为??????????????????????????。
化学式
| 电离平衡常数(25 ℃)
|
HCN
| K=4.9×10-10
|
H2CO3
| K1=4.3×10-7、K2=5.6×10-11
?
参考答案:(1)1×10-11、 < 、 促进?(2) 2?、
本题解析:
试题分析:(1)由图中曲线可知,25℃时水的离子积Kw = c(H+) × c(OH-)=10-14 ,95℃时水的离子积Kw = c(H+) × c(OH-)=10-12?,Kw(25 ℃)> Kw(95℃),且95℃的氢氧化钠溶液中,当c(OH-)="0.1" mol·L-1 时,由水电离的c(H+) =10-12 /0.1 mol·L-1 =10-11 ;往水中加水解的盐,将促进水的电离。
(2)因为HA为一元酸,所以有0.001molHA电离,则C(H+)="0.001mol÷
本题难度:一般
|