微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将0.2mol AgNO3、0.4mol Cu(NO3)2、0.6mol KCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3mol Cu,此时在另一极上产生的气体体积(标准状况)为
A.4.48L
B.5.6L
C.6.72L
D.7.84L
参考答案:C
本题解析:由Ag++Cl-=AgCl↓可知,0.2molAg+和0.2molCl-沉淀;
在阴极上有0.3molCu2+放电: Cu2++2e-=Cu,转移电子为0.6mol;
在阳极上先有0.6mol-0.2mol=0.4mol的Cl-放电:2Cl--2e-=Cl2↑,生成氯气0.2mol;然后为保证电子的得失守恒,又有0.2mol的OH-放电:4OH--4e-=2H2O+O2↑,生成0.05mol氧气,共生成0.25mol气体,体积为6.72升
答案为C
本题难度:简单
2、填空题 已知33As、35Br位于同一周期。某反应中反应物与生成物有以下几种:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式是 。
(3)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将该反应方程式配平后,氧化剂和还原剂的物质的量之比为 ,其中1 mol KBrO3得到电子的物质的量为 mol。
参考答案:(1)AsH3 (2)Br2 (3)ac (4)8∶5 5
本题解析:(1)KBrO3在反应中得到电子,化合价降低,KBrO3为氧化剂,则X为对应的还原产物。比较余下物质中各元素化合价的变化,可知AsH3在反应中失去电子,为还原剂,被氧化生成H3AsO4。(2)设X中Br元素的化合价为x,则有:0.2 mol×(5-x)=1 mol,解得x=0,故X为Br2。(3)写出化学反应方程式:AsH3+KBrO3+H2SO4
本题难度:一般
3、选择题 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是(????)
①生成物的体积分数一定增加?
②生成物的产量一定增加?
③反应物的转化率一定增加?
④反应物的浓度一定降低?
⑤正反应速率一定大于逆反应速率
A.①②④⑤
B.①②③⑤
C.②③
D.②⑤
参考答案:D
本题解析:题中给定了平衡的移动方向,要求判断引起平衡移动的原因及可能产生的结果。平衡向正方向移动,由于改变条件不明,反应物的转化率、浓度均无法确定,则应具体分析使平衡发生移动的原因。若是通过改变温度或改变压强使平衡发生移动,①③④所述情况是成立的;若是通过增加反应物的浓度使平衡向正方向移动,若增加反应物的量很多,生成物体积分数必然降低(混合气体的总物质的量增加),该反应物的浓度较原浓度增大(增加部分较原转化的浓度要少),该物质的转化率较低,故①③④均不确定。由于反应向正方向移动,生成更多的生成物,生成物的量必然增加,故②正确;平衡向正方向移动,必是正反应速率大于逆反应速率的结果,故⑤正确。
本题难度:困难
4、选择题 烷烃  是烯烃R和氢气发生加成反应后的产物,则R可能的结构简式有
是烯烃R和氢气发生加成反应后的产物,则R可能的结构简式有
A.4种
B.5种
C.6种
D.7种
参考答案:C
本题解析:试题分析:烯烃和氢气发生加成反应生成烷烃,则反过来,烷烃分子中相邻的碳原子上如果各自去掉1个氢原子,就可以形成碳碳双键。据此可知,根据该烷烃的结构简式可知,可能的结构有6种,其中碳碳双键的位置分别是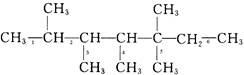 ,答案选C。
,答案选C。
考点:考查烯烃结构简式的判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,主要是考查学生对烯烃加成反应以及烯烃结构的了解掌握程度,以及灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和逆向思维能力,提高学生的应试能力和学习效率。
本题难度:简单
5、选择题 下列化学变化中,需加入氧化剂才能实现的是
A.C→CO2
B.CO2→CO
C.CuO→Cu
D.H2SO4→BaSO4
参考答案:A
本题解析:
试题分析:需加入氧化剂才能实现,说明元素的化合价是升高的。A、由0→+4,化合价升高了,正确;B、由+4 +2,化合价降低,需要还原剂,不符合题意;C、由+2
+2,化合价降低,需要还原剂,不符合题意;C、由+2 0,化合价降低,需要还原剂,不符合题意;D、没有化合价的变化。
0,化合价降低,需要还原剂,不符合题意;D、没有化合价的变化。
考点:考查氧化剂还原剂的概念。
本题难度:一般