微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)生产生活中广泛涉及氧化还原反应。
(1)工业上冶炼下列物质通常不采用电解法的是 。
a.Na b.Mg c.Fe d.Ag
(2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的 极,b极的电极反应式为 。

(3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为 ,X的化学式为 ,该反应的氧化剂和还原剂的物质的量之比为 。
(4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式 。
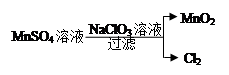
参考答案:(1)cd (2分)
(2)正(1分) Cu2++2e
本题解析:
试题分析:(1)Na、Mg为活泼金属,无法用还原剂还原化合物制取金属单质,Fe可用还原剂还原化合物制取金属单质,Ag可用加热Ag2O的方法制取Ag,故cd项正确。
(2)电解精炼铜,粗铜为阳极,连接在电源的正极;b极为阴极,电解质溶液中的Cu2+在阴极上得电子,电解方程式为:Cu2++2e?=Cu。
(3)已知X为单质,在反应中NaN3失去电子,可推出X为N2,KNO3中N元素化合价降低,在反应中得电子,所以KNO3为氧化剂;根据氧化反应中氧化剂所得电子总数与还原剂失去电子总数相等,可得n(NaN3)=5n(KNO3),所以氧化剂和还原剂的物质的量之比,即n(KNO3):n(NaN3)=1:5.
(4)根据图示可知,ClO3?把Mn2+氧化为MnO2,可得离子方程式为:5Mn2+ + 2ClO3? + 4H2O = 5MnO2↓+ Cl2↑+ 8H+
考点:本题考查金属的冶炼、电解精炼铜、氧化还原反应原理及应用、离子方程式的书写。
本题难度:一般
2、选择题 标准状况下,32g某气体的分子数与9g H2O的分子数相同,该气体的摩尔质量为
A.32
B.32 g·mol-1
C.64 g·mol-1
D.64
参考答案:C
本题解析:9g水是0.5mol,所以32g该气体也是0.5mol,则其摩尔质量是32g÷0.5mol=64g/mol,答案选C。
本题难度:困难
3、选择题 下列反应的离子方程式中,错误的是
A.向苏打溶液中加入稀盐酸:CO32-+2H+=CO2↑+H2O
B.将CO2通入过量的NaOH溶液中:CO2+2OH-=CO32-
C.用Cl2将苦卤中的Br-氧化:Cl2 +2Br- =2Cl- + Br2
D.将金属钠投入到水中:2Na+2H2O=2Na++2OH-+H2↑
参考答案:B
本题解析:B错误,元素不守恒,正确的应该是:CO2+2OH-=CO32-+H2O
本题难度:简单
4、选择题 下列变化过程属于氧化反应的是
A.HCl→H2
B.Mg→Mg2+
C.Cl-→AgCl
D.CuO→Cu
参考答案:B
本题解析:
试题分析:物质要发生氧化反应,则元素的化合价就会升高,HCl→H2化合价降低,错;Mg→Mg2+化合价升高,B对;Cl-→AgCl化合价没有改变,C错; CuO→Cu化合价降低,D错。
考点:氧化还原反应中元素的性质和发生的反应
本题难度:简单
5、选择题 将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是 ( )
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-)可能为7∶3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
参考答案:C
本题解析:
试题分析:A、由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.03L×10mol/L=0.3mol,根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.3mol,故参加反应的氯气n(Cl2)=0.15mol,故A错误; B、根据方程式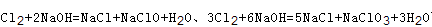 可知,氧化产物只有NaClO时,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误; C、根据方程式
可知,氧化产物只有NaClO时,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误; C、根据方程式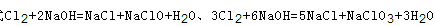 可知,氧化产物只有NaClO时,转移电子数最少,为
可知,氧化产物只有NaClO时,转移电子数最少,为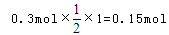 氧化产物只有NaClO3时,转移电子数最多,为
氧化产物只有NaClO3时,转移电子数最多,为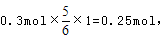 故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;
故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;
考点:考查氧化还原反应计算、根据方程式的计算等相关知识点
本题难度:一般