均无明显现象(无气泡)
(1)写出以上反应的离子方程式______________________________________??。
(2)分析上表数据,你得出的结论是:??????????????????????????????????。
(3)你认为出现以上现象的可能原因是(写出一个即可):
__________________________________??????___________________?_;
(4)请设计实验对你的假设进行验证:
_______________________________________________????___________;
(5)如果上述假设都成立,要使以上稀硫酸与铝反应产生的氢气速率加快,可以采取的措施有(列举三个):????????????????????????????????????????????????????
参考答案:(1)2Al+6H+==2Al3++3H2↑(2′)
本题解析:(1)金属绿意稀硫酸或盐酸反应放出氢气,反应的离子方程式是
2Al+6H+==2Al3++3H2↑。
(2)根据反应的剧烈程度及生成的气泡多少可知,其结论应该是Al在c(H+)相同的盐酸中反应比在硫酸中快得多。
(3)根据题意,两种溶液中不同的是酸根离子,所以可能的原因是①Cl-对铝与H+反应有促进作用;②SO42-对铝与H+反应有抑制作用。
(4)如果验证以上的假设,则可以通过对照实验进行对比,即①向以上稀硫酸中加入少量的氯化钠或氯化钾(或其他可溶性氯化物)固体,如果都能使反应速
本题难度:一般
2、选择题 对于可逆反应A(g)+2B(g) 2C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是(?????) 2C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,且使A的浓度增大,应采取的措施是(?????)
A.增大压强
B.减少B的浓度
C.减少A的浓度
D.升高温度
参考答案:B
本题解析:
试题分析:A.增大压强,反应物A、B的浓度都增大,正反应速率加快。错误。B.减少B的浓度,由于反应物的浓度降低,所以正反应速率降低。根据平衡移动原理:减小反应物的浓度,平衡逆向移动,产生更多的反应物A。由于A的浓度也增大。正确。C.减少A的浓度,由于反应物的浓度降低,所以正反应速率降低,但是A的浓度也减少,不符合题意,错误。D.升高温度。无论是正反应速率还是逆反应速率都加快。根据平衡移动原理,升高温度,化学 向吸热反应方向移动。对该反应来说,升高温度,化学平衡向正反应方向移动,所以A的浓度减小。错
本题难度:一般
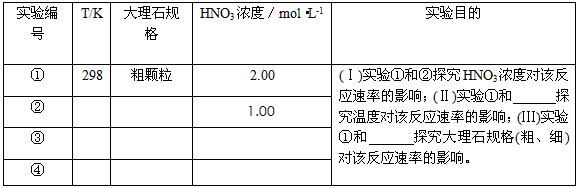
3、实验题 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为
1.00 mol·L-1、2.00mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验
HNO3的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号
(2)实验①中CO2质量随时间变化的关系见下图
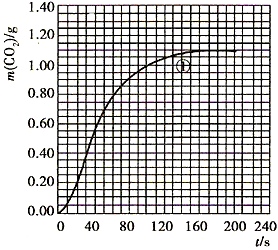
依据反应方程式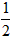 CaCO3+HNO3== CaCO3+HNO3== Ca(NO3)2+ Ca(NO3)2+ CO2↑+ CO2↑+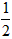 H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。 H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
参考答案:(1)![]() 本题解析: 本题解析:
本题难度:困难
4、选择题 100 mL 6 mol·L-1的H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
①Na2CO3溶液 ②水 ③K2SO4溶液 ④KNO3溶液
A.①③
B.②③
C.①④
D.②④
参考答案:B
本题解析:
试题分析:①加入Na2CO3溶液,与酸反应,生成氢气的量减少,故错误;②氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,故正确;③加适量的K2SO4溶液,相当于稀释,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,故正确;④加入硝酸钾,硝酸根离子在酸性条件下具有强氧化性,与锌反应生成NO气体,不生成氢气,故错误,故选B。
考点:考查影响化学反应速率的因素
本题难度:一般
5、选择题 影响化学反应速率的因素很多,下列措施一定能使化学反应速率增大的是 [???? ]
A.升高温度
B.增大压强
C.降低浓度
D.减小压强
参考答案:A
本题解析:
本题难度:一般
|