微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 4mol A和2mol B放入2L密闭容器中发生反应2A(g)+B(g)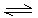 2C(g),△H<0。4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L
2C(g),△H<0。4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L 。下列说法正确的是
。下列说法正确的是
A. 4s内,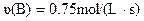
B. 当c(A):c(B):c(C)=2:1:2时,该反应即达到平衡状态
C. 达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D. 达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
参考答案:A
本题解析:略
本题难度:一般
2、选择题 已知可逆反应: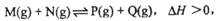 在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)="2.4" mol·L-1;达到平衡后,M的转化率为60%,若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,
在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)="2.4" mol·L-1;达到平衡后,M的转化率为60%,若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,
c(N)=" a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a为?????????????????(????)
A.5
B.6
C.7
D.8
参考答案:B
本题解析:略
本题难度:一般
3、选择题 如果mg氨气由x个原子构成,则在2mg硫化氢中含有的分子数为
A.0.25x
B.0.5x
C.2x
D.4x
参考答案:A
本题解析:
本题难度:一般
4、选择题 一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是
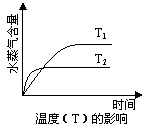 ?
?
A.CO2(g) + 2NH3(g) CO(NH2)2(s) + H2O(g);△H<0
CO(NH2)2(s) + H2O(g);△H<0
B.CO2(g) + H2(g) CO(g) + H2O(g);△H>0
CO(g) + H2O(g);△H>0
C.CH3CH2OH (g) CH2=CH2(g) + H2O(g);△H>0
CH2=CH2(g) + H2O(g);△H>0
D.2C6H5CH2CH3(g) + O2(g) 2 C6H5CH=CH2(g) + 2H2O(g);△H<0
2 C6H5CH=CH2(g) + 2H2O(g);△H<0
参考答案:A
本题解析:A中反应是体积减小的、放热的可逆反应,所以温度越低、压强越大,水蒸气的含量越高,正确、B中反应前后体积不变,改变压强平衡不移动,不正确。C中是吸热反应,升高温度,水蒸气的含量增大,不正确。D中反应是体积增大的,增大压强平衡向逆反应方向移动,水蒸气含量降低,不正确,答案选A。
本题难度:简单
5、填空题 环境中常见的重金属污染物有:汞.铅.锰.铬.镉。处理工业废水中含有的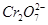 和
和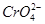 ,常用的方法有两种。
,常用的方法有两种。
方法1 还原沉淀法该法的工艺流程为
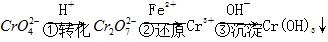 。
。
其中第①步存在平衡2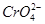 (黄色)+2H+
(黄色)+2H+
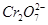 (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol 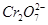 ,需要________mol的FeSO4·7H2O。
,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  ?Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
?Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
方法2 电解法
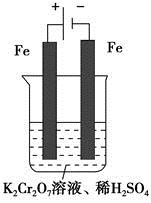
(5)实验室利用如图装置模拟电解法处理含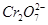 的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
参考答案:
(1) 本题解析:(1)稀溶液中H2O的浓度可视为常数,故第①步反应的平衡常数表达式为K=c(
本题解析:(1)稀溶液中H2O的浓度可视为常数,故第①步反应的平衡常数表达式为K=c(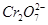 )/[c2(
)/[c2(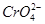 )·c2(H+)]。(2)由反应①可知,平衡发生移动,溶液的pH发生变化,故pH不变时说明反应达到平衡,A项正确;
)·c2(H+)]。(2)由反应①可知,平衡发生移动,溶液的pH发生变化,故pH不变时说明反应达到平衡,A项正确;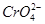 和
和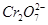 中Cr均为+6价,该反应不是氧化还原反应,B项错误;在酸性环境中,溶液中c(
中Cr均为+6价,该反应不是氧化还原反应,B项错误;在酸性环境中,溶液中c(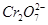 )较大,溶液呈橙色,C项正确。(3)在第②步反应中
)较大,溶液呈橙色,C项正确。(3)在第②步反应中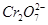 被还原为Cr3+,0.1 mol
被还原为Cr3+,0.1 mol 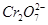 被还原时转移电子的物质的量为0.1 mol×2×(6-3)=0.6 mol,而还原剂Fe2+被氧化为Fe3+,故需要消耗0.6 mol FeSO4·7H2O。(4)在第②步反应中Fe2+被氧化为Fe3+,故第③步还有Fe(OH)3生成。(5)电解池的阳极发生氧化反应,Fe作阳极,则Fe电极本身被氧化,故阳极反应式为Fe-2e-=Fe2+;阴极则是电解质溶液中的H+得电子,发生还原反应生成氢气,故阴极反应式为2H++2e-=H2↑;阳极生成的金属阳离子移向阴极,而阴极反应消耗了H+,打破了水的电离平衡,促进了水的电离,使溶液中的OH-浓度增大,溶液逐渐呈碱性,从而使金属阳离子在阴极区形成沉淀。
被还原时转移电子的物质的量为0.1 mol×2×(6-3)=0.6 mol,而还原剂Fe2+被氧化为Fe3+,故需要消耗0.6 mol FeSO4·7H2O。(4)在第②步反应中Fe2+被氧化为Fe3+,故第③步还有Fe(OH)3生成。(5)电解池的阳极发生氧化反应,Fe作阳极,则Fe电极本身被氧化,故阳极反应式为Fe-2e-=Fe2+;阴极则是电解质溶液中的H+得电子,发生还原反应生成氢气,故阴极反应式为2H++2e-=H2↑;阳极生成的金属阳离子移向阴极,而阴极反应消耗了H+,打破了水的电离平衡,促进了水的电离,使溶液中的OH-浓度增大,溶液逐渐呈碱性,从而使金属阳离子在阴极区形成沉淀。
本题难度:一般