微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
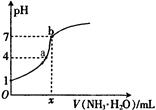
1、选择题 向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示。下列判断正确的是( )??
 ?
?
A.x=20
B.稀H2SO4的浓度为0.10mol/L
C.b点有:2c(NH4+) = c(SO42-)> c(H+) = c(OH-)
D.a点有:c(NH4+) < 2c(SO42-)
参考答案:D
本题解析:
试题分析:图中稀硫酸的pH为1,则其浓度为0.05mol/L,B错误;氨水为弱碱,部分电离,若x=20,则此时溶液为酸性,A错误;b点时,溶液呈中性,故c(H+) = c(OH-),而c(NH4+) ="2" c(SO42-),故C错误;b点时,溶质为硫酸铵,c(NH4+) :c(SO42-)=2:1,故a点有:c(NH4+) < 2c(SO42-),D正确。
点评:弱电解质的电离是历年高考的重点,难度较大,考生在备考过程中应注意积累各个知识点的考查形式。
本题难度:一般
2、填空题 (8分)为了测定草酸晶体(H2C2O4·xH2O)中的x值,进行如下实验
(1)称取Wg草酸晶体,配成100.00mL溶液
(2)取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L—1的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答:
①实验中,需要的仪器有(填序号)??????????,还缺少的仪器有(填名称)?????????
??????????????????????????????????
A.托盘天平(带砝码、镊子)
B.滴定管
C.100mL的量筒
D.100mL的容量瓶
E、烧杯???? F、漏斗??? G、锥形瓶?? H、玻璃棒? I、药匙?? J、烧瓶
②实验中,标准液KMnO4溶液应装在?????式滴定管中,因为????????????????
????????????????????????????????
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x的值会???????(填偏大、偏小、无影响)。
④在滴定过程中若用去amol·L—1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为????????mol·L—1,由此,x=???????????。
⑤若滴定终点读数时俯视刻度,则计算的x值会????????(填偏大、偏小、无影响)。
参考答案:
①ABDEGHI ,胶头滴管、铁架台带滴定管夹?
本题解析:
试题分析:本题考察实验仪器的组装和实验基本操作,并附带考察与实验相关的分析与计算。同时对于滴定过程中需要注意的有关事项进行考察。在接近滴定终点时,用少量蒸馏水对锥形瓶内壁进行冲洗,不会影响本滴定物质的总物质的量,所以X值也不会改变。利用标准物质和待测定物质之间存在的等量关系,建立起计算框架,根据题目给出的化学反应方程式进行计算即可。
点评:本题的解题思路在于测定一定质量的草酸晶体中草酸的物质的量,再根据草酸的摩尔质量解出原来草酸晶体中草酸的质量,剩下的就是结晶水的质量。根据这个解题思路来设计
本题难度:一般
3、选择题 (10分) 某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,该温度________25℃(填“大于”“小于”或“等于”),其理由是________________________________________________________________________
________________________________________________________________________.
此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1) 若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2) 若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3) 若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.
参考答案:10-13(1分)大于(1分) 水的电离是吸热的,升温时水的
本题解析:由题意可知, 0.01mol/L的NaOH中[OH]=0.01mol/L。而此状态下,溶液pH=11,也就是说[H]=1×10-11mol/L。所以,此状态下水的Kw=[H] ×[OH]=1×10-13mol/L。该温度大于25℃,理由是水的电离是吸热的,升温时水的电离平衡向右移动,KW增大,因该温度下的KW大于25℃时水的KW,所以该温度大于25℃。
(1)NaOH溶液pH=12,则[H]=1×10-12,[OH]=Kw/[H]=(1×10-13)/(1×10-12)=0.1mol/L。
本题难度:简单
4、实验题 (1)在中和热的测定实验中,取50 mL 0.50 mol /L的盐酸,需加入下列??????试剂(填序号)。①50 mL0.50 mol/L NaOH溶液??②50 mL0.55 mol/L NaOH溶液③1.0 g NaOH固体
(2)在硫酸铜晶体结晶水含量的测定实验中,若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体中结晶水的质量分数ω=____________________(写计算式)。如果实验中加热温度过高,固体颜色变黑,则测定结果会____________(填“不变”、“偏高”、“偏低”)。
参考答案:(1)②???(2) 本题解析:(1)在中和热的测定中,为保证盐酸完全反应,加入的氢氧化钠是过量的,答案选②。晶体中结晶水的质量分数ω=
本题解析:(1)在中和热的测定中,为保证盐酸完全反应,加入的氢氧化钠是过量的,答案选②。晶体中结晶水的质量分数ω=
(2)根据实验可知,m1-m是硫酸铜晶体的质量,m1-m2是结晶水的质量,所以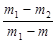 ×100%;如果实验中加热温度过高,固体颜色变黑,硫酸铜分解,即m2偏小,所以结晶水的含量偏高。
×100%;如果实验中加热温度过高,固体颜色变黑,硫酸铜分解,即m2偏小,所以结晶水的含量偏高。
本题难度:一般
5、选择题 用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是(????)
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,加入少量的蒸馏水再进行滴定
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
参考答案:C
本题解析:A中相当于稀释盐酸的浓度,测定结果偏高;锥形瓶不能用标准液润洗,否则测定结果偏高;C中蒸馏水没有改变氢氧化钠的物质的量,所以不影响结果;D不正确,应该是半分钟内不褪色,因此正确的答案选C。
本题难度:一般