微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:
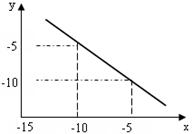
(1)该温度下水的离子积为 。
(2)该温度下0.01 mol/L NaOH溶液的pH为 。
参考答案:(1)10-15??(2)13
本题解析:(1)根据图像可知,当x=-10时,y=-5,所以该温度下水的离子积为10-10×10-5=10-15。
(2)0.01 mol/LNaOH溶液中c(OH-)=0.01 mol/L,所以氢离子浓度为10-15÷0.01=10-13mol/L,因此pH=13。
本题难度:一般
2、填空题 (8分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。?请回答:
⑴在④操作中用到的量取仪器是??????????。以上步骤有错误的是(填编号)?????????,该错误操作会导致测定结果有误差。下列操作会造成同样的测定结果的是???????????????。
①锥形瓶用待测溶液润洗??????????????????????②滴定前读数正确,滴定后俯视读数
③碱式滴定管滴定前无气泡,滴定终点时有气泡??④滴定前读数正确,滴定后仰视读数
⑤配制NaOH溶液时,称量的NaOH中含NaCl??⑥振荡锥形瓶时部分液体溅出
⑵如下图是某次滴定时的滴定管中的液面,其读数为???????mL。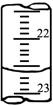
参考答案:(1)酸式滴定管?①??①④⑤?????(2)22.60
本题解析:
试题分析::(1)向锥形瓶中取未知浓度的盐酸要用酸式滴定管。滴定管在加入液体前必须用待装液润洗,所以①步错误,不润洗会使滴定管中溶液浓度偏低,消耗溶液体积偏大,使测定结果偏大。锥形瓶用待测液润洗,标准液的体积比正常值大,则浓度偏大;滴定前读数正确,滴定后俯视读数,标准液的体积比正常值小,则浓度偏小;碱式滴定管滴定前无气泡,滴定终点时有气泡,标准液的体积比正常值小,则浓度偏小;滴定前读数正确,滴定后仰视读数,标准液的体积比正常值大,则浓度偏大;配制NaOH溶液时,称量的NaOH中含NaCl,标准液的
本题难度:一般
3、填空题 (15分)甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol,甲醚可作燃料电池的燃料。
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+6H2(g)+O2(g)==2CH3OCH3 (g)的反应热为 ;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是
______(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将
________(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将__________;
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为____________________;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:
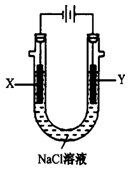
请写出电解过程中Y电极附近观察到的现象 ;当燃料电池消耗2.8 LO2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
参考答案:(1)CH3OCH3(g)+3O2(g)=2CO2(g)+3
本题解析:
试题分析:(1)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,甲醚的燃烧热为1455 kJ/mol,则甲醚燃烧的热化学方程式为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H= —1455kJ/mol;已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1,则有关的热化学方程式为:①H2(g)+1/2O2(g)=H2O(l)△H=-285.8KJ/mol;②C(s)+O2(g)=CO2(g)△H=-393.5KJ/mol;③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H=-1455kJ/mol,所以根据盖斯定律可知①×3+②×2-③得到反应热化学方程式为:2C(s)+3H2(g)+1/2O2(g)=CH2OCH3(g) △H=-169.4kJ/mol,即4C(s)+6H2(g)+O2(g)=2CH2OCH3(g) △H=-378.8kJ/mol;
(2)①在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A、氢气是反应前,水蒸气是生成物,因此当c(H2)与c(H2O)的比值保持不变时可以说明反应达到平衡状态,a正确;b、根据方程式可知单位时间内有2mol H2消耗时一定有1mol H2O生成,因此不能据此说明达到平衡状态,b错误;c、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器中气体密度不再改变不能说明达到平衡状态,c错误;D、正方应是压强减小的可逆反应,因此当容器中气体压强不再改变是能说明达到平衡状态,d正确,答案选ad。
②正方应是放热反应,因此温度升高,该化学平衡向逆反应方向移动,到达新的平衡,CH3OCH3的产率将变小。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,物质的量增大,则混合气体的平均式量将变小。
(3)原电池负极失去电子,发生氧化反应。因此甲醚在负极放电,碱性条件下生成碳酸根离子与水,则电极反应式为CH3OCH3+16OH-—12e-=2CO32-+11H2O;
(4)根据装置图可知Y电极与电源的正极相连,作阳极。溶液中的氯离子放电生成氯气,因此Y电极附近溶液中有气体产生,上部分呈黄绿色;标准状况下2.8LO2的物质的量是2.8L÷22.4L/mol=0.125mol,根据电极反应O2+2H2O+4e-=4OH-可知电子转移为0.125mol×4=0.5mol。所以根据电子守恒可知电解池中也转移0.5mol电子,因此根据阳极电极反应为4OH--4e-=2H2O+O2↑可知生成氢氧根离子的物质的量是0.5mol,其浓度是0.5mol÷0.5L=1.0mol/L,所以溶液中氢离子浓度是10-14mol/L,因此溶液的pH=14。
考点:考查燃烧热、热化学方程式、盖斯定律、平衡状态判断、外界条件对平衡状态的影响以及电化学原理的应用等
本题难度:一般
4、选择题 人体口腔内唾液的pH通常约为7,在进食过程的最初10 min,酸性逐渐增强,之后酸性逐渐减弱,至40 min趋于正常。下列曲线与上述事实最接近的是( )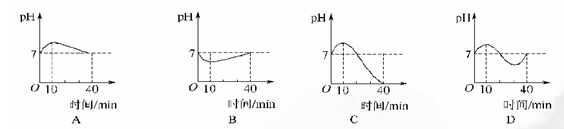
参考答案:B
本题解析:考查pH的有关判断。氢离子浓度的负对数是pH,所以PH越大,酸性越弱,所以选项B是正确的,答案选B。
本题难度:一般
5、选择题 水的电离平衡曲线如图所示,下列说法不正确的是:
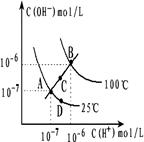
A.图中四点Kw间的关系: A=D<C<B
B.若从A 点到D点,可采用:温度不变在水中加入少量酸
点到D点,可采用:温度不变在水中加入少量酸
C.若从A点到C点,可采用:温度不变在水中加入少量NH4Cl固体
D.若处在B点,将pH=2的硫酸与pH=10的KOH的两种溶液等体积混合后,溶液显中性
参考答案:C
本题解析:略
本题难度:一般