微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知25℃时,CaSO4在水中的沉淀溶解平衡曲线,如图所示,向100mL该条件下的CaSO4饱和溶液中,加入400mL?0.01mol/L的Na2SO4溶液,针对此过程的下列叙述正确的是( )
A.溶液中析出CaSO4沉淀,最终溶液中c(SO
?
2-4
)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO?
2-4
)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO?
2-4
)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO?
2-4
)较原来大
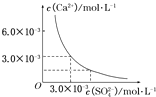
参考答案:由图示可知,在该条件下,CaSO4饱和溶液中,c(Ca2+)
本题解析:
本题难度:简单
2、选择题 难溶物BaSO4在水中的溶解平衡可表示为:BaSO4(s)?Ba2+(aq)+SO42-(aq).其溶度积常数Ksp=C(Ba2+)?C(SO42-),某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
A.d点无BaSO4沉淀生成
B.加入Na2SO4可以使溶液由a点变到b点
C.通过蒸发可以使溶液由d点变到c点
D.a点对应的Ksp大于c点对应的Ksp

参考答案:A、d点表示Qc<Ksp,溶液不饱和,不会有沉淀析出,故A正
本题解析:
本题难度:一般
3、选择题 某温度下,
 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液 ,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
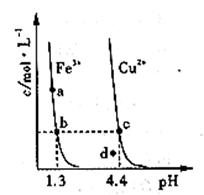
A.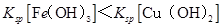
B.加适量 固体可使溶液由
固体可使溶液由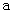 点变到
点变到 点
点
C.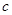
 两点代表的溶液中
两点代表的溶液中 与
与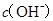 乘积相等
乘积相等
D.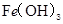 、
、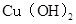 分别在
分别在 、
、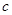 两点代表的溶液中达到饱和
两点代表的溶液中达到饱和
参考答案:B
本题解析:A、由b、c两点对应数据可比较出KSP[Fe(OH)3]与KSP[Cu(OH)2]的大小,KSP[Fe(OH)3]=c(Fe3+)·(OH-)3=c(Fe3+)·(10-12.7)3,KSP[Cu(OH)2]=c(Cu2+)·(OH-)2=c(Cu2+)·(10-9.6)2,因c(Fe3+)=c(Cu2+),故KSP[Fe(OH)3]<KSP[Cu(OH)2],A正确;
B、向溶液中加入NH4Cl固体,不会导致溶液中的c(OH-)增大,故不能使溶液由a点变到b点,B错误;
C、只要温度不
本题难度:一般
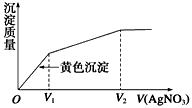
4、选择题 往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。则原溶液中c(I-)/c(Cl-)的比值为
 [???? ]
[???? ]
A.(V2-V1)/V1
B.V1/V2
C.V1/(V2-V1)
D.V2/V1
参考答案:C
本题解析:
本题难度:一般
5、填空题 (8分)对可逆反应aA(g)+bB(g)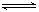 cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系: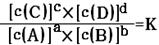 (为一常数),K称为化学平衡常数,它的值只与温度有关。现有反应:CO(g)+H2O(g)
(为一常数),K称为化学平衡常数,它的值只与温度有关。现有反应:CO(g)+H2O(g)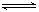 CO2(g)+H2(g),△H<0。在850℃时,K=1。
CO2(g)+H2(g),△H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K?????????1(填“大于”、“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:①当x=5.0时,上述平衡向????????????(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是??????????。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a????????????b(填“大于”、“小于”或“等于”)。
参考答案:(1)小于?(2)①逆反应?????②x<3.
本题解析:
试题分析:(1)CO(g)+H2O(g)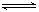 CO2(g)+H2(g),△H<0。反应放热。根据勒夏特列原理,升温平衡向吸热反应方向移动。对该反应而言即为左移。化学平衡常数K减小。填 “小于”。① 根据化学平衡常数K表达式与QC表达式的关系。QC大于K平衡向逆反
CO2(g)+H2(g),△H<0。反应放热。根据勒夏特列原理,升温平衡向吸热反应方向移动。对该反应而言即为左移。化学平衡常数K减小。填 “小于”。① 根据化学平衡常数K表达式与QC表达式的关系。QC大于K平衡向逆反
本题难度:一般
网站客服QQ: 960335752 - 14613519 - 791315772