微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知,常温下,KSP (AgCl)=1.8×10-10 mol2·L-2,KSP(AgI)=8.3×10-17 mol2·L-2,下列叙述中,正确的是
A.常温下,AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小
B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色
C.将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-)
参考答案:B
本题解析:考查溶解平衡
A:KSP只与温度有关,不正确
B:由于KSP (AgCl)>KSP(AgI),向AgCl的悬浊液中加入KI溶液,I—将结合Ag+形成AgI沉淀,并且促进AgCl溶解平衡的正向进行,正确
C:是否产生沉淀,还与溶液中I—、Cl—的浓度有关,不正确
D:AgCl的饱和溶液中,c(Ag+)=c(Cl-),但加入NaCl晶体后,c(Cl-)增大,c(Ag+)<
本题难度:一般
2、填空题 (15分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
A.连接好仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2 SO2 +2Cu。
SO2 +2Cu。
F.移取25.00mL含SO2的水溶液于250mL锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
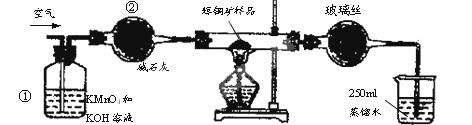
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为??????????????????????????????????????????,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
滴定
次数
| 待测溶液的
体积/mL
| 标准溶液的体积
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 25.00
| 1.04
| 21.03
|
2
| 25.00
| 1.98
| 21.99
|
3
| 25.00
| 3.20
| 21.24
(4)本方案设计中由一个明显的缺陷影响了测定结果(不属于操作失误),你认为是?????????????????????????????????????????????????????????(写一种即可)。
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系:c2 (H+)·(S2-) =" 1" . 0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H十)为__________________。
参考答案:
(1)除去空气中的还原性气体与酸性气体???????
本题解析:
试题分析:
(1)装置①的作用是:除去空气中的还原性气体与酸性气体;装置②的作用是:干燥空气。
(2)2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O???????滴入最后一滴标准KMnO4溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色
(3)高锰酸钾三次的次的用量分别为:19.99 mL、20.01 mL、18.04 mL,第三组数据有明显的误差,可以舍去不用,前两次的的平均值为:20.00mL
2KMnO4-----------------
本题难度:一般
3、填空题 (12分)
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Co(OH)2
| Al(OH)3
| 开始沉淀
| 2.3
| 7.5
| 7.6
| 3.4
| 完全沉淀
| 4.1
| 9.7
| 9.2
| 5.2
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为   。 。
(2)加入碳酸钠调节pH至a,a的范围是 ;
(3)操作Ⅰ包含3个基本实验操作,它们是 、 和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是 。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 (任写1点)。
参考答案:(12分)
(1)减少有毒气体的排放,防止大气污染;防
本题解析:略
本题难度:困难
4、填空题 工业上制备BaCl2的工艺流程图如下
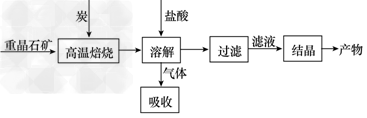
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C(s) 4CO(g)+BaS(s) ΔH1=571.2?kJ/mol ① 4CO(g)+BaS(s) ΔH1=571.2?kJ/mol ①
BaSO4(s)+2C(s) 2CO2(g)+BaS(s) ΔH2=226.2?kJ/mol ② 2CO2(g)+BaS(s) ΔH2=226.2?kJ/mol ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为__________________________________________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =________。 =________。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g) 2CO(g)的ΔH3=____kJ/mol。 2CO(g)的ΔH3=____kJ/mol。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是__________________________________________________。
参考答案:(1)S2-+H2O![]() 本题解析: 本题解析:
本题难度:一般
5、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。
已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-)。下列说法正确的是
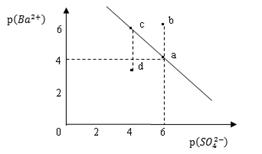
A.该温度下,Ksp (BaSO4 )=1.0×10-24
B.a点的Ksp (BaSO4 )小于b点的Ksp (BaSO4 )
C.d点表示的是该温度下BaSO4的不饱和溶液
D.加入BaCl2可以使溶液由 c点变到a点
参考答案:D
本题解析:
试题分析:A、硫酸钡电离产生硫酸根离子和钡离子,a点时p(Ba2+)=-lgc(Ba2+)=4,则c(Ba2+)=10-4mol/L,p(SO42-)=-lgc(SO42-)=6,则c(SO42-)=10-6mol/L,所以该温度下,Ksp (BaSO4 )= c(Ba2+) c(SO42-)=1.0×10-10,错误;B、温度相同,硫酸钡的溶度积相同,错误;C、因为p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-)是减函数,数值越小,则对应的两种浓度越大,所以d点时c(Ba2+) c(SO42-)>1.0×10-10,则溶液为过饱和溶液,错误;D、c点时加入氯化钡溶液,则溶液中的钡离子浓度增大,p(Ba2+)减小,则溶解平衡逆向移动,硫酸根离子浓度减小,p(SO42-)增大,可由c点变到a点,正确,答案选D。
考点:考查对沉淀溶解平衡图像的分析判断
本题难度:一般
|
|