微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
(1)若加入AgNO3固体,c(I-)?????????。
(2)若加入更多的AgI固体,则c(Ag+)?????????。
(3)若加入固体AgBr,c(I-)?????????。
参考答案:(1)减小??(2)不变???(3)减小
本题解析:根据碘化银的溶解平衡AgI(s) Ag+(aq)+I-(aq)可知,如果增大银离子浓度,则平衡向左进行,则碘离子浓度减小;温度不变,溶解度不变,所以再加入碘化银固体,溶液的浓度也是不变的;由于溴化银的溶解度大,所以溶液中银离子浓度,则碘离子浓度减小。
Ag+(aq)+I-(aq)可知,如果增大银离子浓度,则平衡向左进行,则碘离子浓度减小;温度不变,溶解度不变,所以再加入碘化银固体,溶液的浓度也是不变的;由于溴化银的溶解度大,所以溶液中银离子浓度,则碘离子浓度减小。
本题难度:一般
2、填空题 (本题共12分)磷是重要的非金属元素。
28.有关白磷(P4)的叙述正确的是 (选填编号)。
a.易溶于CS2 b.易自燃 c.分子中有4个P-P键
P4在过量的热NaOH溶液中会生成PH3气体和NaH2PO2(次磷酸钠),写出该反应的化学方程式 。
由该反应可推知H3PO2为 元酸。用NaH2PO2来验证次磷酸是弱酸,还需要的物质是 。
29.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是 (选填编号)。
a.升高 b.降低 c.既升高又降低
30.25℃时,HF的Ki =" 3.6×10"
参考答案:
本题解析:
本题难度:一般
3、实验题 某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
实验步骤
| 向3—4 mL? 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全。
|
实验现象
| 产生白色沉淀
|
离子方程式
| ?
(1)??????????????????????????????????????
|
小组讨论交流
| 向上述反应后的清液中滴入适量1mol/L的Na2CO3溶液会出现什么现象
|
假设出现的实验现象,说明理由
| 假设Ⅰ: 无现象; ??????理由:反应没有限度,Ca2+沉淀完全
假设Ⅱ:(2)???????????,理由:(3)?????????????????????????
|
证明你的假设
| 现象:产生大量的白色沉淀?
|
离子方程式
| ?
(4)???????????????????????????????????????????????????????????????????
|
实验结论
| ?
(5)????????????????????????????????????????????????????????????
参考答案:(1)Ca2++SO42-=CaSO4↓???????(2)
本题解析:探究CaCl2溶液和Na2SO4溶液反应有没有限度,生成白色沉淀。反应存在限度, Ca2+沉淀不完全,反应是可逆反应,存在反应限度。
本题难度:一般
4、选择题 取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.结合上述实验数据(已知lg2=0.3),下列有关说法正确的是( )
A.常温下,0.0025mol/LNaOH溶液?pH=11.4
B.在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的Ksp减小
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,离子浓度变化如图所示
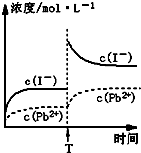
D.本次实验测得的t℃PbI2的Ksp=4×10-9
参考答案:A、常温下,0.0025mol/LNaOH溶液中c(OH-)
本题解析:
本题难度:一般
5、实验题 (18分)铁是广泛应用的金属。
(1)铁元素在周期表中的位置是 ,工业上通常采用高炉炼铁的方法制得单质铁,请写出用赤铁矿与CO反应炼铁的化学方程式 。
(2)请补充完成实验室制备Fe(OH)3胶体的操作步骤:
①取25ml蒸馏水加热至沸腾
②
③继续煮沸至
④停止加热。
(3)几种离子生成氢氧化物沉淀的pH如下表(已知Fe(OH)2呈絮状,不易从溶液中除去)
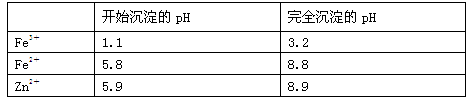
注:开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算现有某溶液含有Fe2+、Fe3+、Zn2+、SO42-,要使溶液中的Fe2+和Fe3+完全沉淀,需往溶液中先加入H2O2,作用是 ,然后再加入NH4HCO3调节pH至 ,NH4HCO3中起调节pH作用的离子是 (填离子符号)
①设计实验探究铁钉和钢钉在碱性溶液中遇到高锰酸钾时是否能发生电化学腐蚀。实验如下
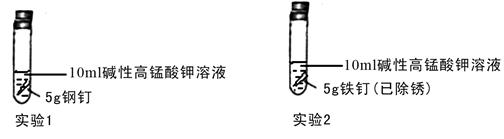
①完成下列表格

②实验2比实验1能够较快看到以上现象的原因是 。
参考答案:(1)第四周期 第VIII族 (2分)
本题解析:
试题分析:铁元素是第四周期,第VIII族元素,工业上通常采用高炉炼铁的方法制得单质铁:3CO + Fe2O3 2Fe +3 CO2;(2)实验室制备Fe(OH)3胶体的操作步骤为:①取25ml蒸馏水加热至沸腾;②向沸水中逐滴加入5-6滴FeCl3饱和溶液;③继续煮沸至液体呈透明的红褐色,即得到Fe(OH)3胶体;④停止加热。(3)含有Fe2+、Fe3+、Zn2+、SO42-的溶液中,要使溶液中的Fe2+和Fe3+完全沉淀,先往溶液中加入H2O2将Fe2+氧化为Fe3+,然后再加入NH4HCO3调节pH至3.2 以上使Fe3+完全沉淀,但pH<5.9,防止Zn2+转化为沉淀;加入NH4HCO3是使溶液中的H+离子浓度降低,故起调节pH作用的离子是HCO3- ;(4) ①钢铁中含有Fe、C,C、Fe和电解质溶液构成原电池,Fe易失电子作负极,电极反应式为Fe-2e-=Fe2+,C为正极,正极上MnO4-得电子发生还原反应,电极反应式为MnO4-+e- = MnO42-,短时间溶液由紫红色(MnO4-)变为深绿色(MnO42-),随后Fe 2++2OH- =Fe(OH)2 ↓;Fe(OH)2+2OH- + MnO4-=Fe(OH)3 +MnO42-;Fe(OH)3 = Fe2O3 ·nH2O等反应进行,因此可知: 2Fe +3 CO2;(2)实验室制备Fe(OH)3胶体的操作步骤为:①取25ml蒸馏水加热至沸腾;②向沸水中逐滴加入5-6滴FeCl3饱和溶液;③继续煮沸至液体呈透明的红褐色,即得到Fe(OH)3胶体;④停止加热。(3)含有Fe2+、Fe3+、Zn2+、SO42-的溶液中,要使溶液中的Fe2+和Fe3+完全沉淀,先往溶液中加入H2O2将Fe2+氧化为Fe3+,然后再加入NH4HCO3调节pH至3.2 以上使Fe3+完全沉淀,但pH<5.9,防止Zn2+转化为沉淀;加入NH4HCO3是使溶液中的H+离子浓度降低,故起调节pH作用的离子是HCO3- ;(4) ①钢铁中含有Fe、C,C、Fe和电解质溶液构成原电池,Fe易失电子作负极,电极反应式为Fe-2e-=Fe2+,C为正极,正极上MnO4-得电子发生还原反应,电极反应式为MnO4-+e- = MnO42-,短时间溶液由紫红色(MnO4-)变为深绿色(MnO42-),随后Fe 2++2OH- =Fe(OH)2 ↓;Fe(OH)2+2OH- + MnO4-=Fe(OH)3 +MnO42-;Fe(OH)3 = Fe2O3 ·nH2O等反应进行,因此可知:

②实验2比实验1能够较快看到以上现象的原因是:铁钉中的碳和铁构成了原电池的正负极,加快反应速率,能发生电化学腐蚀。
考点:考查铁及其化合物的性质,胶体,电化学腐蚀的探究实验设计。
本题难度:一般
|