微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
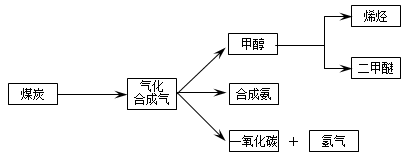
I.已知该产业链中某反应的平衡表达式为:K= ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa, 温度230~280℃)进行下列反应:
温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中总反应的热化学方程式为 。830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是 ,其原因是 .

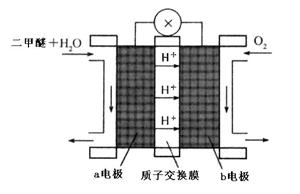
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示。写出a电极上发生的电极反应式  。
。
参考答案:C(s)+H2O(g) 本题解析:略
本题解析:略
本题难度:困难
2、填空题 (15分)已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T(K)
| 938
| 1100
|
K
| 0.68
| 0.40
①写出该反应平衡常数的表达式__________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量_____;充入氦气,混合气体的密度____(选填“增大”、“减小”、“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
| C6H5ONa
| pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
| 11.3
①上述盐溶液中的阴离子,结合质子能力最强的是
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 ;
将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于 ;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原的千分之一)则应向溶液里加NaOH溶液,使溶液pH为 。
参考答案:⑴ ①k= 本题解析: 本题解析:
试题分析:(1)①该反应平衡常数的表达式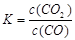 ;②由于温度升高,化学平衡常数减小。说明升高温度,平衡逆向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应。若升高温度,平衡逆向移动,气体的质量减小,而气体的物质的量不变,所以混合气体的平均相对分子质量减小;充入氦气,化学平衡不发生移动,但在整个容器内气体的质量增大,所以混合气体的密度增大;(2)①同种浓度的离子结合质子能力越强,则盐水解程度就越大,盐溶液的碱性就越强,即pH越大。由于Na2CO3溶液的pH最大,说明CO32-与H+结合力最强。因此上述盐溶液中的阴离子,结合质子能力最强的是CO32-。③发生反应时应该是强酸制取弱酸。A.酸性CH3COOH> H2CO3,正确。B.酸性CH3COOH> HCN.正确。C. H2CO3>HClO。正确。D.由于酸性:H2CO3>C6H5OH> HCO3-,所以会发生反应CO2+H2O+C6H5ONa=NaHCO3+C6H5OH。错误。④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为:2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO。(3)c (Cu2+)·c2(OH-)≥Ksp=2×10-20; c2(OH-)≥2×10-20÷0.02=1×10-18; c(OH-)≥1×10-9;所以pH=5; c(Cu2+)= 0.2 mol/L÷1000=2×10-4mol/L,则c2(OH-)≥2×10-20÷2×10-4mol/L=1×10-16,所以c(OH-)≥1×10-8;pH=6. ;②由于温度升高,化学平衡常数减小。说明升高温度,平衡逆向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应。若升高温度,平衡逆向移动,气体的质量减小,而气体的物质的量不变,所以混合气体的平均相对分子质量减小;充入氦气,化学平衡不发生移动,但在整个容器内气体的质量增大,所以混合气体的密度增大;(2)①同种浓度的离子结合质子能力越强,则盐水解程度就越大,盐溶液的碱性就越强,即pH越大。由于Na2CO3溶液的pH最大,说明CO32-与H+结合力最强。因此上述盐溶液中的阴离子,结合质子能力最强的是CO32-。③发生反应时应该是强酸制取弱酸。A.酸性CH3COOH> H2CO3,正确。B.酸性CH3COOH> HCN.正确。C. H2CO3>HClO。正确。D.由于酸性:H2CO3>C6H5OH> HCO3-,所以会发生反应CO2+H2O+C6H5ONa=NaHCO3+C6H5OH。错误。④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为:2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO。(3)c (Cu2+)·c2(OH-)≥Ksp=2×10-20; c2(OH-)≥2×10-20÷0.02=1×10-18; c(OH-)≥1×10-9;所以pH=5; c(Cu2+)= 0.2 mol/L÷1000=2×10-4mol/L,则c2(OH-)≥2×10-20÷2×10-4mol/L=1×10-16,所以c(OH-)≥1×10-8;pH=6.
考点:考查化学平衡常数的表达式、温度对化学平衡移动的影响、盐的水解规律、离子方程式的书写、沉淀溶解平衡的应用的知识。
本题难度:困难
3、选择题 升高温度,下列数据不一定增大的是( )
A.化学平衡常数K
B.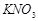 的溶解度s 的溶解度s
C.化学反应速率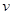
D.水的离子积常数Kw
参考答案:A
本题解析:升高温度BCD都是增大的,但平衡的移动方向无法判断,所以平衡常数不一定是增大的,答案选A。
本题难度:一般
4、选择题 现用氯水来制取含有次氯酸的溶液,既要提高溶液中HClO物质的量浓度,又要降低溶液中HCl浓度,下列措施可以采用的是
A.加热挥发HCl
B.加水使平衡向正反应方向移动
C.加NaOH固体
D.加CaCO3固体
参考答案:D
本题解析:
试题分析:由化学方程式Cl2+H2O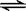 HClO+HCl可知:A、加热平衡向正反应方向移动,但是挥发HCl的同时,HClO也分解,HClO物质的量浓度将减小,错误;B、加水平衡向正反应方向移动,但是HCl和HClO物质的量浓度将减小,错误;C、加入NaOH,分别生成NaCl和NaClO,HClO和HCl浓度都减小,错误;D、CaCO3与HClO不反应,却和HCl反应,使平衡向右移动,从而提高HClO浓度,降低了HCl浓度,正确。 HClO+HCl可知:A、加热平衡向正反应方向移动,但是挥发HCl的同时,HClO也分解,HClO物质的量浓度将减小,错误;B、加水平衡向正反应方向移动,但是HCl和HClO物质的量浓度将减小,错误;C、加入NaOH,分别生成NaCl和NaClO,HClO和HCl浓度都减小,错误;D、CaCO3与HClO不反应,却和HCl反应,使平衡向右移动,从而提高HClO浓度,降低了HCl浓度,正确。
考点:平衡移动问题。
本题难度:一般
5、选择题 如右图表示温度和压强对平衡状态下可逆反应2M(g)+N(g) 2Q(g) ΔH<0的影响。下列有关说法正确的是 2Q(g) ΔH<0的影响。下列有关说法正确的是
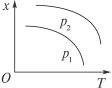
A.x不可能是M或N的体积分数
B.x可能是混合气体的物质的量
C.该反应在p1时先达到化学平衡状态
D.p 1>p2
参考答案:A
本题解析:因为正反应是放热反应且是气体体积缩小的反应,所以x不可能是M或N的体积分数,也不可能是混合气体的物质的量;x可能是生成物Q的体积分数,且压强应是p1<p2,即该反应在p2时先达到化学平衡状态。故正确答案为A项。
本题难度:简单
|
|