微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)某硝酸厂处理尾气中NO的方法是:催化剂存在时用H2将NO还原为N2。已知:

则氮气和水蒸气反应生成氢气和一氧化氮的热化学方程式是 。
(2)在压强为0.1 Mpa条件,将a mol CO和3a mol H2的混合气体在催化剂作用下转化为甲醇的反应如下:CO(g)+2H2(g) CH3OH(g) ΔH<0。
CH3OH(g) ΔH<0。
①该反应的平衡常数表达式为________________。
②若容器容积不变,下列措施可增大甲醇产率的是________。
A.升高温度
B.将CH3OH从体系中分离
C.充入He,使体系总压强增大
(3)某研究小组在实验室研究某催化剂效果时,测得NO转化为N2的转化率随温度变化情况如图。

①若不使用CO,温度超过775 ℃,发现NO的分解率降低,其可能的原因为________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。

写出C2H6与NO2发生反应的化学方程式________________。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为________________________。
参考答案:(1)N2(g)+2H2O(g)===2NO(g)+2H2(
本题解析:
试题分析:(1)化学反应方程式为N2+2H2O===2NO+2H2,由图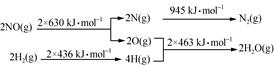 可知,ΔH=945+4×463-2×630-2×436=+665 kJ·mol-1,故热化学方程式为N2(g)+2H2O(g)===2NO(g)+2H2(g) ΔH=+665 kJ·mol-1;
可知,ΔH=945+4×463-2×630-2×436=+665 kJ·mol-1,故热化学方程式为N2(g)+2H2O(g)===2NO(g)+2H2(g) ΔH=+665 kJ·mol-1;
(2)由热化学方程式CO(g)+2H2(g) CH3OH(g) ΔH<0可知,平衡常数K=
CH3OH(g) ΔH<0可知,平衡常数K=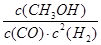 ;欲增大甲醇产率,则应使该平衡正向移动,升高温度,平衡向着吸热的方向移动,该平衡逆移, 将CH3OH从体系中分离,可使平衡正移,充入He,使体系总压强增大,该平衡不移动,故选择B;
;欲增大甲醇产率,则应使该平衡正向移动,升高温度,平衡向着吸热的方向移动,该平衡逆移, 将CH3OH从体系中分离,可使平衡正移,充入He,使体系总压强增大,该平衡不移动,故选择B;
(3)①由图可知,若不使用CO,温度超过775 ℃,发现NO的分解率降低,则该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在n(NO)/n(CO)=1的条件下,应控制最佳温度在850-900℃之间;
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,C2H6与NO2反应,生成无污染的N2和CO2,反应方程式为4C2H6+14NO2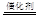 8CO2+7N2+12H2O;
8CO2+7N2+12H2O;
(4)以NO2、O2、熔融NaNO3组成的燃料电池,由图可知,石墨Ⅰ为燃料电池的负极,负极失电子,生成一种氧化物Y,电极反应为NO2+NO3--e-===N2O5。
考点:热化学方程式的书写,平衡常数的计算,化学平衡的移动,图像的描述,化学反应方程式的书写,电极反应的书写
本题难度:困难
2、简答题 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol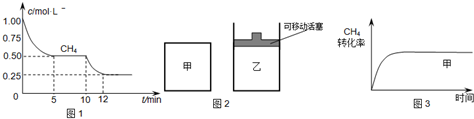
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应中处于平衡状态的时间为______;10min时,改变的外界条件可能是______.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应CO(g)+H2O(g)?CO2(g)+H2(g)800℃时,反应的化学平衡常数K=1.0.
①某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2
0.5mol
8.5mol
2.0mol
2.0mol
此时反应中正、逆反应速率的关系式是______(填代号).
a.v(正)>v(逆)b.v(正)<v(逆)c.v(正)=v(逆)d.无法判断
②800℃时,向体积为2L的密闭容器中充入2molCO和4molH2O,求达到平衡时CO的转化率.
参考答案:(1)由图可知,由图可知,在5~10分钟、12分钟后,甲烷浓
本题解析:
本题难度:简单
3、填空题 (17分)利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g) CO(g来源:www.91exam.org)+3H2(g)。 CO(g来源:www.91exam.org)+3H2(g)。
(1)甲烷与水蒸气反应,被氧化的元素是 ,当生成标准状况下35.84L合成气时转移电子的物质的量是 。
(2)将2 mol CH4和5 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度、压强的关系如图。
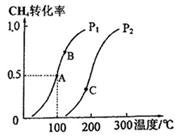
①达到A点所需的时间为5min,则v(H2)= ,100℃时平衡常数K= 。
②图中的Pl P2(填“<”、“>”或“=”),A、B、C三点的平衡常数KA、KB、KC的大小关系是 。
(3)合成气用于合成氨气时需除去CO,发生反应CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g)  H<0, H<0,
下列措施中能使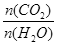 增大的 (选填编号)。 增大的 (选填编号)。
A.降低温度 B.恒温恒容下充入He(g)
C.将H2从体系中分离 D.再通入一定量的水蒸气
可用碳酸钾溶液吸收生成的CO2,常温下pH=10的碳酸钾溶液中水电离的OH-的物质的量浓度为 ,常温下,0.1 mol·L-1KHCO3溶液pH>8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”)。
参考答案:(17分)(1)C(碳)(1分) 2
本题解析:
试题分析:(1)甲烷与水蒸气反应,甲烷中的碳元素由-4价变为反应后CO中的+2价,化合价升高,失去电子被氧化。因此被氧化的元素是C;根据方程式可知,每产生4mol的气体,转移电子的物质的量是6mol的电子,现在得到的气体的物质的量是:n=35.84L÷22.4L/mol=1.6mol,所以转移电子的物质的量是n(e-)="(1.6mol÷4)" ×6=2.4mol;(2)①由于CH4的转化率是0.5,所以发生反应消耗的甲烷的物质的量是2 mol×0.5=1mol,根据方程式可知,每有1mol的甲烷反应,会产生3mol 的氢气,所以v(H2)=3mol÷100L÷5min=0.006mol·L-1·min-1;在100℃时,反应达到平衡时,各种物质的浓度分别是:c(CH4)=0.01mol/L;c(H2O)=0.04mol/L;c(CO)=0.01mol/L;c(H2)=0.03mol/L,所以该反应的平衡常数是: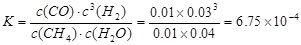 ;②根据图像可知:在温度不变时,在压强为p1时CO的转化率大于p2时CO的转化率,由于该反应的正反应为气体体积增大的反应,所以在温度不变时,减小压强,平衡向气体体积增大的正反应方向移动,所以压强:Pl <P2;(3)CO(g)+H2O(g) ;②根据图像可知:在温度不变时,在压强为p1时CO的转化率大于p2时CO的转化率,由于该反应的正反应为气体体积增大的反应,所以在温度不变时,减小压强,平衡向气体体积增大的正反应方向移动,所以压强:Pl <P2;(3)CO(g)+H2O(g) CO2(g)+H2(g)的正反应为放热反应,A.降低温度,平衡向放热反应方向移动,n(CO2)增大,n(H2O)减小,所以n(CO2)/ n(H2O)增大,正确;B.恒温恒容下充入He(g),由于物质的浓度都不变,所以平衡不发生移动,n(CO2)/ n(H2O)不变,错误;C.将H2从体系中分离,减小生成物的浓度,平衡正向移动,n(CO2)增大,n(H2O)减小,所以n(CO2)/ n(H2O)增大,正确;D.再通入一定量的水蒸气,即增大反应物的浓度,平衡正向移动,n(CO2)增大,n(H2O)增大,而且平衡移动趋势是微弱的,所以n(CO2)/ n(H2O)反而减小,错误。故正确选项是AC;常温下pH=10的碳酸钾溶液中,c(H+)=10-10mol/L,则c(OH-)=10-4mol/L,水溶液中的OH-就是水电离产生的,所以水电离的OH-的物质的量浓度为10-4mol/L;在1KHCO3溶液中存在HCO3-的水解作用和它的电离作用,电离产生H+使溶液显酸性;水解消耗H+,使溶液显碱性,由于0.1 mol·L-1KHCO3溶液pH>8,则说明HCO3-的水解作用大于电离作用,所以溶液中c(H2CO3)>c(CO32-)。 CO2(g)+H2(g)的正反应为放热反应,A.降低温度,平衡向放热反应方向移动,n(CO2)增大,n(H2O)减小,所以n(CO2)/ n(H2O)增大,正确;B.恒温恒容下充入He(g),由于物质的浓度都不变,所以平衡不发生移动,n(CO2)/ n(H2O)不变,错误;C.将H2从体系中分离,减小生成物的浓度,平衡正向移动,n(CO2)增大,n(H2O)减小,所以n(CO2)/ n(H2O)增大,正确;D.再通入一定量的水蒸气,即增大反应物的浓度,平衡正向移动,n(CO2)增大,n(H2O)增大,而且平衡移动趋势是微弱的,所以n(CO2)/ n(H2O)反而减小,错误。故正确选项是AC;常温下pH=10的碳酸钾溶液中,c(H+)=10-10mol/L,则c(OH-)=10-4mol/L,水溶液中的OH-就是水电离产生的,所以水电离的OH-的物质的量浓度为10-4mol/L;在1KHCO3溶液中存在HCO3-的水解作用和它的电离作用,电离产生H+使溶液显酸性;水解消耗H+,使溶液显碱性,由于0.1 mol·L-1KHCO3溶液pH>8,则说明HCO3-的水解作用大于电离作用,所以溶液中c(H2CO3)>c(CO32-)。
考点:考查氧化还原反应的有关概念、化学反应速率、化学平衡的有关计算、盐的水解和电离的知识。
本题难度:困难
4、选择题 对于一个恒容密闭容器中进行的可逆反应:mA(气)+nB(气) eC(气)+dD(气) △H<0,下列能证明该反应一定达到平衡状态的是 eC(气)+dD(气) △H<0,下列能证明该反应一定达到平衡状态的是
A.容器内压强不随时间的延长而变化
B.单位时间内每消耗m个A分子的同时也生成了d个D分子
C.单位时间内每生成e个C分子的同时也生成了n个B分子
D.A、B、C、D四种物质的分子数之比为m∶n∶e ∶d
参考答案:C
本题解析:
试题分析:若该反应是一个反应前后气体体积不变的化学反应,无论该反应是否达到平衡状态,容器中气体压强始终不变,故A错误;.单位时间内每消耗m个A分子的同时也生成了d个D分子均指正向反应速率,故B错误;单位时间内每生成e个C分子的同时也生成了n个B分子,既有正向速率又有逆向速率,且符合计量数之比,故C正确;A、B、C、D四种物质的分子数之比为m∶n∶e ∶d不一定达到平衡,故D错误;答案选C.
考点:化学平衡状态的判断依据
本题难度:一般
5、选择题 在一定温度下,固定体积为2 L密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,n(SO2)随时间的变化如表: 2SO3(g) ΔH<0,n(SO2)随时间的变化如表:
时间/min
| 0
| 1
| 2
| 3
| 4
| 5
| n(SO2)/mol
| 0.20
| 0.16
| 0.13
| 0.11
| 0.08
| 0.08
?
则下列说法正确的是( )
A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4 min内该反应的平均速率为0.005 mol/(L·min)
C.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D.平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
参考答案:D
本题解析:对v(SO2)、v(SO3)未指明反应速率的方向,A项错误;0~4 min内O2的平均速率为:v(O2)=v(SO2)/2=(0.20-0.08) mol/(2 L×4 min)×1/2=0.0075 mol/(L·min),B项错误;该反应是放热反应,升高温度,平衡逆向移动,化学平衡常数减小,C项错误;增大氧气的浓度,平衡向右移动,可提高SO2的转化率,但是O2转化率降低,D项正确。
本题难度:一般
|
|