微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)现有①0.2 mol/L NaOH溶液 ②0.2 mol/LHX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH-)????????②中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)上述混合液中共存在????????????种粒子,且c(HX)???c(X-)(填“>”、“<”或“=”,下同),c(HX)+c(X-)???????0.1 mol/L(忽略体积变化)。
(3)上述混合液显????????性(填“酸”、“碱”或“中”),其原因用离子方程式表示为??????。
2、选择题 下列有关弱电解质电离平衡的叙述正确的是
A.达到电离平衡时,分子浓度和离子浓度相等
B.达到电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡
C.电离平衡是相对的、暂时的,外界条件改变时,平衡就可能发生移动
D.电解质达到电离平衡后,各种离子的浓度相等
3、简答题 氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产.氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度.Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值.
下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
[仪器与试剂]酸度计、50mL碱式滴定管、100mL烧杯、0.10mol?L-1?氨水
[实验数据](不必填表格)
| 烧杯号 | V氨水?(mL) | V水(mL) | c?(NH3?H2O)?(mol?L-1) | c(OH-) | Kb | α
1
50.00
0.00
1.34×10-3
2
25.00
25.00
9.48×10-4
3
5.00
45.00
4.24×10-4
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb≈______,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系______
(2)用0.10mol?L-1盐酸分别滴定20.00mL0.10mol?L-1的NaOH溶液和20.00mL0.10mol?L-1氨水所得的滴定曲线如下:
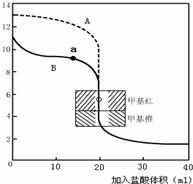
请指出盐酸滴定氨水的曲线为______(填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序______.
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1=______.
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料.其总反应式为4NH3+3O2=2N2+6H2O,正极上的电极反应式为O2+
2H2O+4e-=4OH-,则负极上的电极反应式为______.
4、填空题 写出下列电离方程式
(1)NH4Cl___________________ (2)NaHCO3___________________
(3)NH3?H2O___________________
5、选择题 将0.1mol/L的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,错误的是( )
A.电离程度增大
B.溶液中离子总数增多
C.溶液导电性增强
D.溶液中醋酸分子减少
|