微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在恒温恒容容器中进行反应A(g) 2B(g)+C(g),若A的浓度由0.1 mol·L
2B(g)+C(g),若A的浓度由0.1 mol·L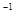 降到0.06 mol·L
降到0.06 mol·L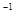 ?需20 s,那么由0.06 mol·L
?需20 s,那么由0.06 mol·L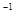 降到0.024 mol·L
降到0.024 mol·L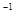 需要的时间
需要的时间
A.等于18s??? B,等于12s??? C,小于18s??? D.大于18s
参考答案:D
本题解析:
试题分析:前20s的平均速率是(0.1-0.06) mol·L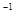 /20s=0.002 mol·L
/20s=0.002 mol·L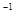 ·s
·s
本题难度:一般
2、实验题 下表是稀硫酸与某金属反应的实验数据:
实验序号
| 金属质量/g
| 金属状态
| c(H2SO4)
/mol·L-1
| V(H2SO4)
/mL
| 溶液温度/℃
| 金属消失的时间/s
|
反应前
| 反应后
|
1
| 0.10
| 粉末
| 0.5
| 50
| 20
| 35
| 50
|
2
| 0.10
| 块状
| 0.8
| 50
| 20
| 35
| 200
|
3
| 0.10
| 粉末
| 0.8
| 50
| 20
| 36
| 25
|
4
| 0.10
| 块状
| 1.0
| 50
| 20
| 35
| 125
分析上述数据,请回答下列问题。
(1)实验1和3表明,??????????????对反应速率有影响,能表明这种影响因素的实验还有????????????(填实验序号)。
(2)本实验中影响反应速率的其他因素还有?????????,其实验序号是???????。该实验说明???????????????,则反应速率越快;
(3)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
????????????????????????????????????????????????????????????????????????????。
参考答案:(7分)(1)硫酸的浓度,实验2、4
(2)固体反应物
本题解析:
试题分析:影响化学反应速率的因素很多:
固体颗粒的大小,在其他条件相同时,固体颗粒越小,反应物的表面积越大,化学反应速率越快;固体颗粒越小,固体反应物的表面积越小,化学反应速率越慢;反应物的浓度,在其他条件相同时,增大反应物的浓度,化学反应速率加快;减小反应物的浓度,反应速率降低;反应物的温度,在其他条件相同时,升高反应物的温度,化学反应速率加快;降低反应物的温度,反应速率降低。
(1)观察实验1和3,金属的质量和金属的状态,溶液的温度均是相同的,但稀硫酸的浓度不同,可知稀硫酸的浓度对
本题难度:一般
3、实验题 (14分?每空2分)化工原料红矾钠(重铬酸钠:Na2Cr2O7·2H2O)主要是以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、SiO2等杂质)为主要原料生产,其主要工艺流程如下:
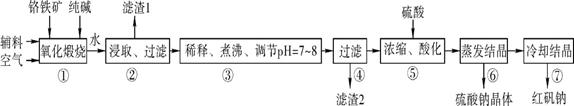
步骤①中主要反应的化学方程式如下:
4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2 8Na2CrO4+2Fe2O3+8CO2
(1) ①中反应是在回转窑中进行的,反应时需不断搅拌,其作用是 ?????????。
(2) 杂质Al2O3在①中转化的化学反应方程式为 ??????????? 。
(3) 用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4) ⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式: ??????????。

(5) 工业上还可用电解法制备重铬酸钠,其装置示意图如上。
阴极的电极反应式为 ????????????????????????????????;
阳极的电极反应式为 ????????????????????????????????。
参考答案:(14分?每空2分) (1) 增大反应物的接触面积,加快反应
本题解析:
试题分析:(1) 固体反应物在搅拌时,可以与氧气充分接触,增大接触面积,使反应速率加快;
(2)氧化铝与碳酸钠在高温条件下发生反应,生成偏铝酸钠和二氧化碳,化学方程式为Al2O3+Na2CO3 2NaAlO2+CO2↑ 2NaAlO2+CO2↑
(3)氧化煅烧再溶于水,所得溶液中有偏铝酸钠、硅酸钠、铬酸钠,其中AlO2
本题难度:一般
4 www.91exAm.org、选择题 在四种不同条件下,反应A + B = 2C + 2D的反应速率如下,其中最快的是( )
A.V(A) =0.15 mol·L-1·S-1 B.V(B) =0.3 mol·L-1·S-1
C.V(C) =0.4 mol·L-1·S-1 D.V(D) =0.45 mol·L-1·S-1
参考答案:B
本题解析:
试题分析:A.v(A)=0.15 mol?L-1?s-1;
B.v(A)=v(B)=0.3 mol?L-1?s-1;
C.v(A)=1/2v(C)=0.2 mol?L-1?s-1;
D.v(A)=1/2v(D)=0.225 mol?L-1?s-1,
则反应速率最大的为B.
考点:化学反应速率
本题难度:一般
5、选择题 对于反应N2+O2?2NO在密闭容器中进行,下列哪些条件能加快反应的速率( )
A.缩小体积使压强增大
B.体积不变充入N2使压强增大
C.体积不变充入H2使压强增大
D.压强不变充入稀有气体氖
参考答案:A.缩小体积,反应物的浓度增大,反应速率增大,故A正确;
本题解析:
本题难度:简单
|