310
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大______________,原因是______________________________________________。
(2)哪一时间段的反应速率最小________________,原因是___________________。
(3)求2~3分钟时间段以硫酸的浓度变化来表示的该反应速率(设溶液体积不变,要写出计算过程)______________________________________________________。
(4)该同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
①上述实验中涉及到的离子反应方程式有
;
②硫酸铜溶液可以加快氢气生成速率的原因是 ;
③实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4 溶液起相似作用的是 ;
④该同学通过实验进一步研究了硫酸铜的量对氢气生成速率的影响。该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
。
参考答案:(1) 2~3min(1分),温度对反应速率影响占主导作用(
本题解析:(1)根据表中数据可知,在0~1、1~2、2~3、3~4、4~5min内收集到的氢气分别是(ml)50、70、112、58、20。所以2~3min内反应速率最大,这是由于反应是放热反应,温度对反应速率的影响超过了浓度对反应速率的影响。
(2)4~5min内收集到的气体最少,所以反应速率最小。这是由于随着反应的进行,反应物
的浓度减小,此时浓度对反应速率的影响超过了温度对反应速率的影响。
(3)略
(4)加入硫酸铜后,新可以置换出铜,从而构成铜锌原电池,锌作负极,加快反应速率。有
关离子方程式为Zn+Cu2+=Zn2++Cu(、Zn+2H+=Zn2++H2↑。由于银的金属性也弱于锌的,所
以也能和锌构成原电池,因此与硫酸铜相似的是硫酸银。如果硫酸铜太多,则生成的单质Cu
会沉积在Zn的表面,降低了Zn与溶液的接触面积,从而降低反应速率。
本题难度:一般
2、选择题 对于反应A+3B═2C+D来说,下列反应速率中最快的是( )
A.v(A)=0.1mol/(L?min)
B.v(B)=0.6mol/(L?min)
C.v(C)=0.5mol/(L?min)
D.v(D)=0.3mol/(L?min)
参考答案:根据各物质的反应速率之比等于其计量数之比,都换算成A的速率,
本题解析:
本题难度:简单
3、填空题 在一定温度下(已知在该温度下,容器内所有物质均为气态),10 L密闭容器中加入5 mol SO2.4 mol O2,经10 min后反应达平衡时有2 mol SO2发生了反应。试计算:
(1)用SO2表示该反应的反应速率;
(2)O2的转化率;
(3)该温度下的平衡常数K(保留三位有效数字)。
参考答案:(1)V(SO2) = 0.020 mol/(
本题解析:略
本题难度:简单
4、选择题 一定温度下,在2L的密闭容器中发生如下反应: B、C的物质的量随时间变化的关系如图l,达平衡后在 B、C的物质的量随时间变化的关系如图l,达平衡后在 时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是 时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
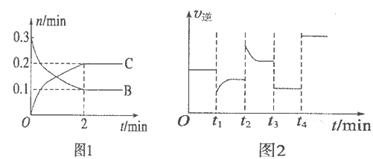
A.x=2,反应开始2 min内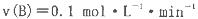
B.t1时是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c (B)不变
参考答案:D
本题解析:
试题分析:A、由图1可知B物质的量减少0.2mol,C的物质的量增加0.2mol,所以x=2;反应开始2 min内B的浓度减少0.2mol/2L=0.1mol/L,则v(B)=0.1mol/L/2min=0.05mol/(L·min),错误;B、t1时逆反应速率迅速减小,随后又增大,说明平衡正向移动,改变的条件可能是减少C的浓度,不可能是降温,因为降温是反应速率逐渐减小,错误;C、t2时逆反应速率迅速增大,随后减小,说明平衡逆向移动,改变的条件可能是增大C的浓度,平衡时的B物质的量浓度增大,但该反
本题难度:一般
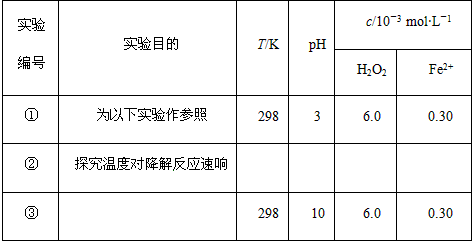
5、实验题 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好 pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该 方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
实验设计
控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
数据处理
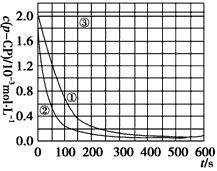
实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率: v(p-CP)=________mol·L-1·s-1。解释与结论
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:________________________________________________________________________。
(4)实验③得出的结论是:pH等于10时,_______________________________。思考与交流
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________。
参考答案:(1)![]()
本题解析:
本题难度:一般
|