微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)化学学习中有很多形如“A+B→C+D”的反应,请根据不同的情况回答下列问题:
(1)如果上式中A、B、C、D均为多核10电子微粒,其中A为阳离子,B为阴离子,C、D均为分子,且C的相对分子质量比D大1。则:
①A+B→C+D表示的离子方程式为 。
②标准状况下,若2.24L的D被50mL 1mol/L硫酸吸收,则所得溶液中各离子浓度从大到小的顺序为____ 。
(2)如果上式中A、C为生活中常见的金属单质,B、D为两种氧化物且它们的摩尔质量比为12:17,其中D能与NaOH溶液反应。则:
①A+B→C+D表示的化学方程式为 。
②D与NaOH溶液反应的化学方程式为___ 。
③若将B溶于盐酸后,再加入足量NaOH溶液可观察到的现象为 。
参考答案:(1)①NH4++ OH- 本题解析:(1)①常见的10电子微粒是He、HF、H2O、NH3、CH4、Na+、Mg2+、Al3+、
本题解析:(1)①常见的10电子微粒是He、HF、H2O、NH3、CH4、Na+、Mg2+、Al3+、
OH-、NH4+、H3O+等。所以根据题意可知,符合条件的方程式为NH4++ OH-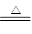 NH3↑+
NH3↑+
H2O。
②氨气是0.1mol,硫酸是0.05mol,所以二者反应生成(NH4)2SO4,(NH4)2SO4水解显酸性,所以;离子浓度大小顺序是c(NH4+) > c(SO42-) > c(H+) > c(OH-)。
(2)①A、C为生活中常见的金属单质,B、D为两种氧化物,因此该反应应该是铝热反应,D是金属铝,B是铁。又因为B、D两种氧化物的摩尔质量比为12:17,所以B的氧化物是氧化亚铁,则方程式为 2Al +3 FeO 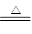 3 Fe + Al2O3。
3 Fe + Al2O3。
②氧化铝是两性氧化物,和氢氧化钠溶液反应的方程式为Al2O3 + 2NaOH ="=" 2NaAlO2 + H2O。
③铁和盐酸反应生成氯化亚铁,因此加入氢氧化钠溶液后的现象是溶液中有白色沉淀生成,白色沉淀迅速变成灰绿色,最终变成红褐色。
本题难度:一般
2、填空题 (16分)工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)制取金属锌的流程如图所示。
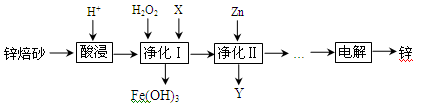
(1)提高酸浸效率的措施为_________________________________(任答一条即可);酸浸时H+与难溶固体ZnFe2O4反应的离子方程式为___________________。
(2)净化Ⅰ中H2O2参与反应的离子方程式为____________________________;X可选择的试剂为______(写化学式)。净化Ⅱ中Y为_____________(写化学式)。
(3)电解法制备锌的装置如图甲所示:

则电解槽中盛有的电解质溶液为______(填字母)。
a.ZnCl2溶液 b.Zn(NO3)2溶液 c.ZnSO4溶液
根据图甲中的数据,可求得电解过程中电流的有效利用率为_________。
(4)使用含有[Zn(OH)4]2-的强碱性电镀液进行镀锌防腐蚀,可得到细致的光滑镀层,电镀时阴极电极反应式_____________________。以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,图乙中锌块的固定位置最好应在_____处(填字母)。
参考答案:(1)增大硫酸的浓度(2分,合理即给分)(或升高温度,或减小
本题解析:
本题难度:困难
3、选择题 下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A.Cu(OH)2+HCl; Cu(OH)2+CH3COOH
B.NaHCO3+H2SO4; Na2CO3+HCl
C.NaHCO3+NaOH; KHCO3+KOH
D.BaCl2+H2SO4; Ba(OH)2+H2SO4
参考答案:C
本题解析:略
本题难度:一般
4、选择题 下列化学反应的离子方程式正确的是
A.金属Fe与稀H2SO4反应:Fe + 2H+== Fe3+ + H2↑
B.Al(OH)3治疗胃酸过多: H++OH—===H2O
C.NaHCO3溶液与NaOH溶液混合:HCO3—+OH— ==H2O + CO2↑
D.Al与NaOH溶液反应:2Al+2OH-+2H2O===2AlO+3H2↑
参考答案:D
本题解析:
试题分析:A、中铁和稀硫酸反应生成硫酸亚铁,应该是Fe +2H+=Fe2++ H2↑;B、Al(OH)3不能拆,错误;C、NaHCO3溶液与NaOH溶液混合:HCO3—+OH—==CO32—+H2O,错误D、Al与NaOH溶液反应:2Al+2OH-+2H2O===2AlO+3H2↑正确。
考点:考查离子方程式的正误判断。
本题难度:一般
5、选择题 下列离子方程式正确的是( )
A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B.碳酸钙与稀硝酸反应:CO32
参考答案:
本题解析:
本题难度:一般