微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 电解100?mL含c(H+)=0.30?mol/L的下列溶液。当电路中通过0.04?mol电子时,理论上析出金属质量最大的是
A.0.10 mol/L Ag+
B.0.20 mol/L Zn2+
C.0.20 mol/L Cu2+
D.0.20 mol/L Pb2+
参考答案:C
本题解析:由题可知各项中含有的离子的物质的量分别为:A项0.01 mol Ag+,0.03 mol H+;B项0.02 mol Zn2+,0.03 mol H+;C项0.02 mol Cu2+,0.03 mol H+;D项0.02 mol Pb2+,0.03 mol H+。根据金属活动性顺序,可知只有H后金属才能析出,故当电路中通过0.04 mol电子时,A项析出0.01 mol Ag(1.08 g),C项析出0.02 mol Cu(1.28 g),其他项无金属析出,故选C项。
本题难度:困难
2、选择题 下列变化需要加入适当的氧化剂才能完成的是
A.Fe → Fe3O4
B.HNO3 → NO
C.H2SO4 → CuSO4
D.Na2O→NaOH
参考答案:A
本题解析:
试题分析:氧化剂是化合价降低,得电子;还原剂是化合价升高,失电子。需要适当的氧化剂才能完成,说明选择的答案是化合价升高的,A、Fe→Fe3O4化合价由0→+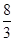 ,化合价升高,正确;B、HNO3→NO,化合价由+5→+2,化合价降低,错误;C、H2SO4→CuSO4化合价无变化,错误;D、Na2O→NaOH化合价无变化,错误。
,化合价升高,正确;B、HNO3→NO,化合价由+5→+2,化合价降低,错误;C、H2SO4→CuSO4化合价无变化,错误;D、Na2O→NaOH化合价无变化,错误。
考点:考查氧化剂、还原剂的概念。
本题难度:一般
3、选择题 为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列六步操作:①过滤,②加稍过量的NaOH溶液,③向滤液中加适量盐酸,④加稍过量的Na2CO3溶液,⑤加稍过量的BaCl2溶液,⑥将滤液蒸发结晶.正确的操作顺序是
A.②④⑤①⑥③
B.⑤②④①③⑥
C.②⑤④①③⑥
D.②④⑤③①⑥
参考答案:BC
本题解析:分析:除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子;过滤后在滤液中加入盐酸到不再生成气体;最后结晶析出.
解答:要先用氯化钡除硫酸根离子,然后再用碳酸钠除钙离子,碳酸钠还可以除去过量的钡离子,所以碳酸钠一定加在氯化钡的后面,如果加反了,过量的钡离子就没法除去,至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,过滤就行了,最后加盐酸除去过量的氢氧根离子碳酸根离子,将滤液蒸发结晶得到氯化钠晶体,即正确的操作顺序是②⑤④①③⑥或⑤②④①③⑥.
故选BC.
点评:本题主要考查了除杂质的原则,以及除杂质的顺序,注意为了将杂质除净,每次所加试剂要过量,这类题时常出现,要加以掌握.
本题难度:一般
4、选择题 已知:NA表示阿伏伽德罗常数,则下列说法正确的是
A.7.8 g Na2O2中所含阴离子的数目是0.2NA
B.标准状况下,2.24 L18O2中所含中子的数目是2NA
C.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1mol/L
D.用足量NaOH溶液完全吸收1 mol Cl2时,转移电子的数目是2NA
参考答案:B
本题解析:A中阴离子为O22-,其数目是(7.8 g/78g.mol-1)×NA =0.1NA
B中(2.24 L/22.4 L. mol -1) ×(18-8) ×2NA =2NA
C中 1 L为水的体积,不是溶液的体积;
D中2NaOH+Cl2=NaCl+NaClO+H2O,Cl的化合价:Cl2中0价,价NaCl中-1价,NaClO中+1价,转移电子的数目是NA
本题难度:困难
5、选择题 下列反应中气体只作氧化剂的是( )
A.Cl2通入水中
B.Cl2通入Na2SO3水溶液中
C.二氧化硫通入氯水中
D.NO2通入水中
参考答案:B
本题解析:略
本题难度:一般