微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 一密闭容器中发生下列反应:N2(g)+3H2(g) 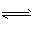 2NH3(g)(正反应为放热反应),如下图所示是某一时间段中反应速率与反应进程的曲线关系。回答下列问题:
2NH3(g)(正反应为放热反应),如下图所示是某一时间段中反应速率与反应进程的曲线关系。回答下列问题:

(1)处于平衡状态的时间段是________。
(2)t1、t3、t4时刻,体系中分别是什么条件?t1______,t3_______,t4______。
(3)下列时间段中,氨的体积分数最高的是___________。
A.t2~t3
B.t3~t4
C.t4~t5
D.t5~t6
参考答案:(1)t0~ t1,t2~t3,t3 ~t4,t5~t6
本题解析:
本题难度:一般
2、填空题 向一容积为5 L的密闭容器中充入NH3和O2,它们的物质的量之比为1∶2,发生如下反应:4NH3+5O2 4NO+6H2O(g)。
4NO+6H2O(g)。
(1)上述反应在一定条件下进行,2 min后该反应的ΔH-TΔS=0,此时该反应达到__________________状态,NH3为2 mol,NH3的转化率为20%。以NO的浓度变化表示该反应的平均反应速率为________________, O2的平衡浓度为_________________。
(2)在达到平衡后,充入相当于原组成气体1倍的惰性气体。如果容器的体积不变,平衡______________移动。
参考答案:(1)平衡 0.05 mol·(L·min)-1 0.875
本题解析:(1)当ΔH-TΔS<0时反应能自发进行;ΔH-TΔS=0,反应处于平衡状态;ΔH-TΔS>0,反应不能自发进行。设起始NH3物质的量为x,则生成NO的物质的量即变化的NH3的物质的量为(x-2) mol,(x-2)÷x=20%,x="2.5" mol,所以,以NO的浓度变化表示该反应的平均反应速率为(2.5 mol-2 mol)÷5 L÷2 min="0.05" mol·(L·min)-1;起始O2的物质的量为5 mol,消耗的O2为:0.5 mol×5/4="0.625" mol,O2的平衡浓度为:(
本题难度:简单
3、选择题 下列说法中,正确的是
[???? ]
A.增大反应物浓度,平衡正向移动,反应物的转化率一定增大
B.正、逆反应速率改变时,平衡一定发生移动
C.对于任何可逆反应,使用催化剂只改变反应速率,不影响平衡
D.增大体系压强,化学反应速率加快,化学平衡一定正向移动
参考答案:C
本题解析:
本题难度:一般
4、选择题 反应2A(g)
参考答案:
本题解析:
本题难度:一般
5、选择题 一定温度下,下列叙述是可逆反应A(g)+3B(g)  ?2C(g)在定容密闭容器中达到平衡的标志的是:①C的生成速率与C的分解速率相等;②单位时间内amol A生成,同时生成3amolB;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤混合气体的平均摩尔质量不再变化;⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;⑦A、B、C的分子数目比为1:3:2;⑧混合气体的密度不再变化
?2C(g)在定容密闭容器中达到平衡的标志的是:①C的生成速率与C的分解速率相等;②单位时间内amol A生成,同时生成3amolB;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤混合气体的平均摩尔质量不再变化;⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;⑦A、B、C的分子数目比为1:3:2;⑧混合气体的密度不再变化
A.②⑤????????? B.①③④⑤?????? C.②⑥⑦⑧?????? D.⑤⑥⑧
参考答案:B
本题解析:
试题分析:①正逆反应的速率相等是平衡的标志。②只描述了逆反应的速率。③浓度不再变化是平衡的标志。④由于反应前后气体的体积会发生变化,所以压强会发生变化,当压强不再变化则达到平衡。⑤反应前后物质的量发生变化,当不再变化时,总物质的量不再变化,平均摩尔质量不再变化。⑥反应即使没有平衡也有这个比例关系。⑦浓度比不一定就为系数比。⑧由于反应体系的体积不变,而总质量也不变,所以混合气体的密度不论是否达到平衡都不变化。
点评:化学反应平衡的标志抓住两个字“等”,即正逆反应速率相等,“定”,即各参与反应的
本题难度:一般