微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
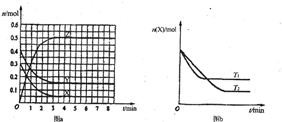
1、选择题 T0℃时,在2L的密闭容器中发生反应:aX(g)+bY(g)?cZ(g),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述不正确的是( )
A.该反应的正反应是放热反应,且T1>T2
B.X、Y、Z的化学反应速率之比为1:1:2
C.图a中反应达到平衡时,Y的转化率为37.5%
D.若T1>T0,则该反应的化学平衡常数K(T1)<K(T0)
参考答案:D
本题解析:
本题难度:简单
2、选择题 一定温度下的反应A(g)+3B(g)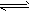 2C(g),下列叙述不能表明它达到化学平衡的是 [???? ]
2C(g),下列叙述不能表明它达到化学平衡的是 [???? ]
A.A、B、C的浓度不再变化
B.混合气体的总物质的量不再变化
C.单位时间内a mol A生成,同时生成3a mol B
D.C的生成速率与C的分解速率相等
参考答案:C
本题解析:
本题难度:一般
3、选择题 700℃时,向容枳为2L的密闭容器中充入一定量的CO和H2O发生反应:
CO(g)+H2O(g)  CO2+H2(g)
CO2+H2(g)
反应过程中测定的部分数据见表。下列说法正确的是

A.反应在t1min内的平均速率为v (H2)=0.4/t1 mol·L-1·min-1
B.其他条件不变,起始时向容器中充入0.60molCO和1.20 mo1H2O,到达平衡时,n(CO2)="0.40" mol
C.其他条件不变,向平衡体系中再通入0.2molH2O,达到新平衡时CO转化率减小
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
参考答案:B
本题解析:
试题分析:A、在t1min内水蒸气的物质的量减少(0.60-0.20)mol=0.40mol,则氢气的物质的量增加0.40mol,所以v (H2)=0.40mol/2L/t1min=0.2/t1 mol·L-1·min-1,错误;B、t1时刻与t2时刻CO的物质的量相同,都是0.8mol,所以t1时达到平衡状态,c(CO)=0.8mol/2L=0.4mol/L,c(H2O)=0.2mol/2L=0.1mol/L,c(CO2)=c(H2)=0.4mol/2L=0.2mol/L,则该反应的平衡常数K= c(CO2)·c(H2)/ c(CO)·c(H2O)=1,其他条件不变,起始时向容器中充入0.60molCO和1.20 mo1H2O,设二氧化碳的浓度为x,则
CO(g)+H2O(g)  CO2+H2(g)
CO2+H2(g)
开始(mol/L) 0.3 0.6
转化(mol/L) x x x x
平衡(mol/L) 0.3-x 0.6-x x x
所以x·x/(0.3-x)·(0.6-x)=1,解得x=0.2mol/L,则,n(CO2)= 0.2mol/L×2L=0.4mol,正确;C、其他条件不变,向平衡体系中再通入0.2molH2O,平衡正向移动,达到新平衡时CO转化率增大,错误;D、温度升至800℃,上述反应平衡常数为0.64,说明升高温度,平衡常数减小,则升高温度,平衡逆向移动,所以正反应是放热反应,错误,答案选B。
考点:考查反应速率、平衡常数的计算与应用,化学平衡移动的判断
本题难度:一般
4、选择题 在一定温度下,可逆反应A(g)+3B(g) 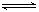 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是
A.C生成的速率与A分解的速率2倍相等
B.单位时间生成n mol A,同时生成3n mol B
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1∶3∶2
参考答案:C
本题解析:
试题分析:A. 在任何时刻都C生成的速率与A分解的速率2倍相等,因此不能判断反应达到平衡状态,错误;B. 在任何时刻都存在单位时间生成n mol A,同时生成3n mol B,因此不能判断反应达到平衡状态,错误;C. 若A、B、C的浓度不再变化,则反应达到平衡,若浓度改变,则未处于平衡状态,正确;D. A、B、C的分子数比为1∶3∶2的状态可能是平衡状态,也可能是非平衡状态,错误。
考点:考查可逆反应平衡状态的判断的知识。
本题难度:一般
5、选择题 在一密闭容器中,反应mA(g)+nB(g) pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
A.化学计量数:m+n<p B.平衡向正反应方向移动
C.物质B的转化率减小 D.物质C的质量分数增加
参考答案:C
本题解析:
试题分析:将容器的体积扩大一倍,若平衡不发生移动,则A的浓度应为0.25 mol·L-1,现在为0.3 mol·L-1,说明平衡向逆反应方向移动了,B错误;将容器的体积扩大一倍,相当于减小压强,平衡向逆反应方向移动,说明逆反应为气体体积增加的反应,所以m+n>p,A错误;因为平衡向逆反应方向移动,B的转化率减小,C的质量分数减少,C正确;D错误;选C。
考点:考查化学平衡的有关计算。
本题难度:一般