微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ·mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ·mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ· mol-1
则Q1、Q2、Q3的关系表示正确的是
[???? ]
A. Q1=Q2
B. Q1 >Q3
C. Q3> Q2> Q1
D. Q1=Q2=Q3
参考答案:B
本题解析:
本题难度:一般
2、选择题 在101kPa和25°C时,有关反应的热化学方程式如下:
C(s)+1/2 O2(g)=CO(g) △H1= -110.5KJ/mol
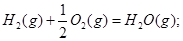
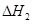 =
=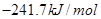

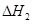 =
=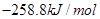
下列说法正确的是( )
A.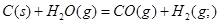 ;
;
B.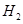 燃烧热的化学方程式为:
燃烧热的化学方程式为: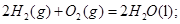
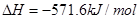
C.
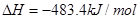
D.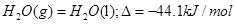
参考答案:D
本题解析:根据盖斯定律可知,①-②即得到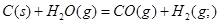 ,所以该反应的反应热△H=-110.5KJ/mol+241.7kJ/mol=+134.2kJ/mol,选项A不正确;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以选项B不正确;水分解是吸热反应,△H大于0,选项C不正确;根据盖斯定律可知,选项D正确,因此正确的答案选D。
,所以该反应的反应热△H=-110.5KJ/mol+241.7kJ/mol=+134.2kJ/mol,选项A不正确;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以选项B不正确;水分解是吸热反应,△H大于0,选项C不正确;根据盖斯定律可知,选项D正确,因此正确的答案选D。
本题难度:一般
3、填空题 (6分)由氢气和氧气反应生成1mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:___ __ ;若1mol液态水变成气态水时要吸收44kJ的热量,则反应H2(g)+1/2O2(g)=H2O(l)的ΔH ="____" kJ/mol。氢气的燃烧热为____ kJ/mol。
参考答案:H2(g)+1/2O2(g)=H2O(g) △H=
本题解析:考查热化学方程式的书写。热化学方程式是表示化学反应与反应热关系的方程式。书写和应用热化学方程式时必须注意以下几点:
①明确写出反应的计量方程式,各物质化学式前的化学计量系数可以是整数,也可以是分数。
②各物质化学式右侧用圆括弧()表明物质的聚集状态。可以用g、l、s分别代表气态、液态、固态。固体有不同晶态时,还需将晶态注明,例如S(斜方),S(单斜),C(石墨),C(金刚石)等。溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq) 代表无限稀释水溶液。
③反应热与反应方程式相互对应。若反应式的书写形式不同,则相应的化学计量系数不同,故反应热亦不同。
④热化学方程式必须标明反应的浓度、温度和压力等条件,若在常温常压时可省略。
氢气和氧气反应生成1mol水蒸气放热241.8 kJ,所以该反应的热化学方程式是H2(g)+1/2O2(g)=H2O(g) △H=-241.8KJ/mol;1mol液态水变成气态水时要吸收44kJ的热量,所以此时的反应热是-(241.8+44)KJ/mol=-285.8kJ/mol;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以氢气的燃烧热是285.8kJ/mol。
本题难度:一般
4、选择题 已知:H+(aq)+OH-(aq)→H2O(l)+57.3kJ.对于下列反应:
①HCl(aq)+NH3?H2O(aq)→NH4Cl(aq)+H2O(l)+a?kJ
②HCl(aq)+NaOH(s)→NaCl(aq)+H2O(l)+b?kJ
③HNO3(aq)+KOH(aq)→KNO3(aq)+H2O(l)+c?kJ
则a、b、c三者的大小关系为( )
A.a>b>c
B.b>c>a
C.a=b=c
D.无法比较
参考答案:B
本题解析:
本题难度:简单
5、填空题 (12分) A,B,C,D,E,F,G是元素周期表前四周期元素,原子序数依次增大,根据下表提供的有关信息,回答下列问题
元素
| 相关信息
|
A
| 所有单质中密度最小
|
B
| 形成化合物种类最多的元素
|
D
| 基态原子中只有3个能级,有2个未成对电子
|
E
| 短周期中原子半径最大
|
F
| 第三周期中电负性最大的元素
|
G
| 最外层只有一个电子,内层填满电子
(1)F元素原子的价电子排布式 ,B,C,D三元素第一电离能由大到小顺序为 (填元素符号)
(2)写出由A,B,C,D四种元素形成的一种简单的既能与酸反应又能与碱反应的化合物
(3)写出由元素E、F形成化合物的水溶液用惰性电极电解的离子方程式
(4)由A,B,C形成的三原子化合物中含有σ键 个,π键 个
(5)已知下列反应:
①G(s) + 1/2O2 (g) =" GO" (s) ; △H=-157.0 KJ/mol
②B(s) + O2 (g) = AO2(g) ; △H=-393.5 KJ/mol
写出单质B与足量GO 反应的热化学方程式
参考答案:(1) 3s23p5 N
本题解析:
试题分析:根据题意可推知:A是H;B是C;C是N,D是O;E是Na;F是Cl;G是Cu。(1)17号元素Cl的原子的价电子排布式是3s23p5;一般情况下同一周期的元素,原子序数越大,元素的电离能就越大,而N原子的最外层电子处于该原子轨道的半充满的稳定状态,失去电子需要的能量比原子序数与其大1的原子还高,所以B,C,D三元素第一电离能由大到小顺序为N>O>C;(2)由A,B,C,D四种元素形成的一种简单的既能与酸反应又能与碱反应的化合物是(NH4)2CO3或NH4HCO3或H2N-CH2-COOH等;(3)在CuCl2的水溶液中由于阳离子的放电能力:Cu2+>H+,所以在阴极电极上Cu2+放电产生Cu单质阴离子的放电能力:Cl->OH-,所以在阳极上Cl-放电产生氯气,故在用惰性电极电解由元素E、F形成化合物的水溶液的离子方程式是2Cl-+ 2 H2O  Cl2↑+ H2↑+2OH-;(4)由A,B,C形成的三原子化合物HCN的结构式是H—C≡N中含有σ键2 个,含有π键2个;(5) ②-①×2,整理可得:2CuO(s) + C(s) ="=" 2 Cu(s) + CO2(g) △H=-79.5kJ/mol。 Cl2↑+ H2↑+2OH-;(4)由A,B,C形成的三原子化合物HCN的结构式是H—C≡N中含有σ键2 个,含有π键2个;(5) ②-①×2,整理可得:2CuO(s) + C(s) ="=" 2 Cu(s) + CO2(g) △H=-79.5kJ/mol。
考点:考查元素及化合物的推断、原子的价电子排布式、物质分子中的化学键的种类和个数、电解原理的应用、热化学方程式的书写的知识。
本题难度:一般
|