微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 同温同压下,已知下列各反应为放热反应,下列各热化学方程式中△H最大的是[???? ]
A.2A (l)+ B(l )= 2C(g) △H1
B.2A (g)+ B(g)= 2C(g) △H2
C.2A (g)+ B(g)= 2C(l) △H3
D.2A (l)+ B(l)= 2C(l) △H4
参考答案:A
本题解析:
本题难度:简单
2、选择题 今有如下三个热化学方程式:下列关于它们的表述正确的是( ? )
H2(g)+ O2(g)=H2O(g);△H=akJ/mol
O2(g)=H2O(g);△H=akJ/mol
H2(g)+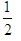 O2(g)=H2O(l);△H=bkJ/mol
O2(g)=H2O(l);△H=bkJ/mol
2H2(g)+O2(g)=2H2O(l);△H=ckJ/mol.
A.它们都是吸热反应
B.a、b和c均为正值
C.反应热的关系:a=b
D.反应热的关系:2b=c
参考答案:D
本题解析:
本题难度:简单
3、选择题 (15分) 现有A、B、C、D、E、F、G七种短周期元素,原子序数依次增大。已知A与E、D与F分别同主族, E、F、G同周期;A、C的最外层电子数之和与D的最外层电子数相等,A与D形成的化合物常温下为液态,A分别与F、G形成的气体分子电子总数相等、B有多种同素异形体,其中一种是原子晶体,是自然界中最硬的物质,可做首饰品或做切削工具。
请回答下列问题:
(1)元素C在周期表中的位置是_______________
元素E的原子结构示意图为
(2)C的气态氢化物的水化物与其最高价氧化物的水化物可发生反应,离子方程式为:
(3)在一定条件下,A、D的单质和A、D、E形成的离子化合物的水溶液可构成电池,该电池负极的电极反应式为 , 该电池在放电过程中,电解质溶液的pH将________(填“增大”、“减小”或“不变”)。
(4)化合物C2A4(g) 是一种高效清洁的火箭燃料,0.25 mol C2A4完全燃烧的生成物是一种气态单质和一种气态化合物,它们对环境无污染,同时放出热量133.5 kJ的热量。则该反应的热化学方程式为(用具体物质化学式表示) 。
参考答案:(15分)
(1)第二周期VA; ![]()
本题解析:
试题分析:B有多种同素异形体,其中一种是原子晶体,是自然界中最硬的物质,可做首饰品或做切削工具,则B为C元素;A与D形成的化合物常温下为液态,则A为H元素、D为O元素;根据原子序数依次增大,C为N元素;已知A与E、D与F分别同主族,这七种元素都位于短周期,A分别与F、G形成的气体分子电子总数相等,所以E为Na元素、F为S元素、G为Cl元素。
(1)C为N元素,在周期表中的位置是:第二周期VA族; Na原子根据示意图: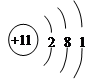
(2)C的气态氢化物的水化物为NH3?H2O,最高价氧化物的水化物为HNO3,发生酸碱中和反应,离子方程式为:NH3.H2O+H+=NH4++H2O
(3)A、D的单质分别为H2、O2,A、D、E形成的离子化合物为NaOH,形成燃料电池,负极发生H2失去电子的反应,电极方程式为:H2+2OH--2e-=2H2O;电池反应为2H2+O2=2H2O,生成了H2O,使NaOH溶液的浓度减小,所以电解质溶液的pH将减小。
(4)化合物C2A4为N2H4,完全燃烧的生成物是一种气态单质和一种气态化合物,它们对环境无污染,则生成物是N2和H2O,0.25 mol N2H4完全燃烧放出热量为133.5 kJ,则1mol N2H4完全燃烧放出热量为534 kJ,所以热化学方程式为:N2H4(g)+O2(g)==N2(g)+2H2O(g) △H ="-534" kJ·mol-1
考点:本题考查元素的推断、原子结构示意图、物质的性质、原电池原理、热化学方程式的书写。
本题难度:一般
4、选择题 SF6是一种优良的绝缘气体,分子结构中只存在S-F键.已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F、S-F键需吸收的能量分别为160kJ、330kJ.则S(s)+3F2(g)→SF6(g)+Q的反应热Q为( )
A.1780kJ
B.1220?kJ
C.450?kJ
D.-430?kJ
参考答案:B
本题解析:
本题难度:简单
5、选择题 已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) △H= +255.6kJ·mol-1
b.CH3CH2OH(g)+1/2O2(g)==3H2(g)+2CO(g) △H= +13.8kJ·mol-1
则下列说法不正确的是
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物原料发酵制得,属于可再生资源
D.由a、b知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ·mol-1
参考答案:A
本题解析:
试题分析:A选项降低温度,会降低b路线中乙醇的转化率。B选项由于b反应发生时需要吸收的热量少,所以从能量消耗的角度来看,b路线制氢更加有利,B正确。C乙醇可通过淀粉等生物原料发酵制得,属于可再生资源,C正确。D选项可以由盖斯定律来计算,要得到2H2(g)+O2(g)=2H2O(g),需用—b—2a,所以△H=—13.8kJ·mol-1—2×255.6kJ·mol-1= 483.6kJ·mol-1故D正确。
考点:能源,盖斯定律
点评:本题从两个热化学方程式出发,考察了转化率,盖斯定律的相关知识,体现了各个知识点的综合,但题目难度一般,属于简单题。
本题难度:一般