微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知热化学方程式C2H2(g)+5/2O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,下列说法正确的是
A.乙炔的燃烧热为1256kJ/mol
B.若转移10mol电子,则消耗2.5mol O2
C.若生成2mol液态水,则△H=-2512kJ/mol
D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ
参考答案:B
本题解析:燃烧热是在一定条件下,1mol可燃物完全燃烧,生成稳定的氧化物时放出的热量,水的稳定状态时液态,A、C不正确;氧气得到4个电子,10mol电子,相应2.5mol氧气,B正确;形成4mol碳氧共用电子对,生成1molCO2,所以放出的热量是628kJ,D不正确,答案选B。
本题难度:一般
2、填空题 (14分)
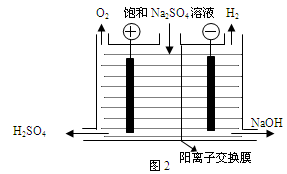
Ⅰ.氯碱工业中常用离子交换膜法电解制碱(如图1所示)。

(1)写出图1中阴极的电极反应式 。
(2)已知阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。工业上若用图2装置电解饱和Na2SO4溶液来生产纯净的NaOH和H2SO4,则该装置最主要的缺陷是 。
Ⅱ.辉钼矿(MoS2)是一种重要的矿物。图3是辉钼矿多层焙烧炉的示意图,其中1,2,3,…是炉层编号。580,600,610,…是各炉层的温度(℃)。图4给出了各炉层固体物料的物质的量百分含量。
已知:MoS2焙烧生成1molMoO3的反应热△H1=-1011KJ/mol;MoO2氧化生成1molMoO3的反应热△H2=-154KJ/mol。试回答:
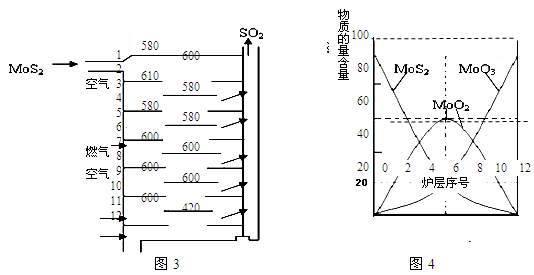
(1)验证辉钼矿焙烧生成的气体是SO2而不是SO3的方法是 。
(2)辉钼矿焙烧生成的气体能使硫酸酸化的KMnO4溶液褪色,用化学方程式表示褪色的原因 。
(3)第6炉层存在的固体物质分别是MoS2、MoO3、MoO2,则它们的物质的量之比为 。
(4)图4表明,中间炉层(4~6)可能存在一种“固体+固体→固体+…”的反应,请写出该反应的热化学反应方程式 。
参考答案: (除标注外,每空2分,共14 分)
本题解析:
试题分析:I、(1)阴极是水中的氢离子放电生成氢气,电极反应式为2H2O + 2e—= H2↑ + 2OH—
(2)该装置中缺少阴离子交换膜,不能阻止氢离子的定向移动,则阳极得不到硫酸产品;
II、(1)二氧化硫的检验使用品红溶液,收集少量气体,将气体通入品红溶液中,观察到品红溶液褪色,加热又恢复原色 ;
(2)焙烧生成的气体能使硫酸酸化的KMnO4溶液褪色,实际是二氧化硫与酸性高锰酸钾溶液的氧化还原反应,化学方程式为 5SO2 + 2H2O + 2KMnO4 = K2SO4 + 2MnSO4 + 2H2SO4
(3)根据图4可知MoS2、MoO3、MoO2的物质的量之比近似等于1:1:3;
(4)图4表明,中间炉层(4~6)中可能存在一种“固体+固体→固体+…”的反应,依据图象变化减小的是反应物,增大的是生成物,反应的化学方程式为:MoS2+6MoO3=7MoO2+2SO2;根据MoS2焙烧生成1molMoO3的反应热△H1=-1011KJ/mol;MoO2氧化生成1molMoO3的反应热△H2=-154KJ/mol及盖斯定律计算出MoS2+6MoO3=7MoO2+2SO2的反应热为+67KJ/mol ,所以该反应的热化学方程式为MoS2(s) + 6MoO3(s) = 7MoO2(s) + 2SO2(g) △H=+67KJ/mol
考点:考查电化学理论的应用,化学方程式、热化学方程式的判断与书写,盖斯定律得应用,流程的分析
本题难度:困难
3、选择题 根据碘与氢气反应的热化学方程式(i)??I2(g)+H2(g)?2HI(g)+9.48kJ???(ii)?I2(S)+H2(g)?2HI(g)-26.48kJ下列判断正确的是( )
A.254gI2(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
参考答案:D
本题解析:
本题难度:简单
4、填空题 X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
元素
| 相关信息
|
X
| X的某种氢化物能使湿润的红色石蕊试纸变蓝
|
Y
| 单质是良好的半导体材料,广泛应用于光电信息领域
|
Z
| Z的一种核素质量数为27,中子数为14
|
W
| 最高价氧化物对应的水化物是一种不溶于水的蓝色固体
(1)Z位于元素周期表第 周期第 族,W基态原子的核外电子排布式为
(2)X的第一电离能比Y的 (填“大”或“小”),X的单质分子中σ键和π键的数目比为 ,Y氧化物属于 晶体。
(3)X的氢化物(X2H4)的制备方法之一是将NaC1O溶液和XH3反应制得,试写出该反应的化学方程式 。
(4)己知下列数据:
4W(s)+O2(g)=2W2O(s) △H=一337.2kJ·mol—1
2W(s)+O2(g)=2WO(s) △H=一314.6kJ·mol—1
由W2O和O2反应生成WO的热化学方程式是 。
参考答案:
(1)三 ⅢA 1s22s22
本题解析:
试题分析:根据题意可以推知X、Y、Z、W分别为N、Si、Al、Cu。
(1)Cu为29号元素,故其电子排布式为[Ar]3d94s2;
(2)同周期从上到下,第一电离能依次减小,有N>P;P为3p3,半充满结构,P>Si;因此N>P>Si;氮氮三键中有1个σ键和2个π键;SiO2为原子晶体。
(3)由反应物和产物可以写出
(4)目标反应等于反应②×2-①,根据盖斯定律可得。
考点:本题以物质结构为基础,考查了原子结构、分子结构、晶体结构、元素周期律、盖斯定律及热化学方程式的书写等相关知识。
本题难度:困难
5、选择题 下列热化学方程式,正确的是( ? ) A.4g硫完全燃烧生成SO2,放出37?kJ热量:S(s)+O2(g)=SO2(g);△H=-296kJ/mol
B.1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-73kJ/mol
C.甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1
D.强酸强碱的中和热为-57.3?kJ/mol:Ba(OH)2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l);△H=-114.6?kJ/mol
参考答案:A
本题解析:
本题难度:一般
|
网站客服QQ: 960335752 - 14613519 - 791315772