微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 铅蓄电池是典型的可充电电池,在现代生活中有着广泛的应用,其充电、放电按下式进行:
Pb+PbO2+2H2SO4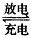 2PbSO4+2H2O,有关该电池的说法正确的是[???? ]
2PbSO4+2H2O,有关该电池的说法正确的是[???? ]
A. 放电时,蓄电池内电路中H+向负极移动
B. 放电时,每通过1 mol电子,蓄电池就要消耗2 mol H2SO4
C. 充电时,阳极反应:PbSO4+2e-=Pb+SO42-
D. 充电时,铅蓄电池的负极与外接电源的负极相连
参考答案:D
本题解析:
本题难度:一般
2、选择题 燃料电池是目前正在探索的一种新型电池,现在已经使用的氢氧燃料电池的基本反应是:x?极:O2(g)+2H2O(l)+4e-→4OH-y极:2H2(g)+4OH--4e-→4H2O(l)+,判断下列说法中正确的是( )
A.x极发生氧化反应
B.x极是负极
C.y极发生氧化反应
D.电子由x极流向y极
参考答案:x?极:O2(g)+2H2O(l)+4e-→4OH-,该反应
本题解析:
本题难度:简单
3、填空题 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H 1=" -" 90.7 kJ·mol-1
CH3OH(g) △H 1=" -" 90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2 =" -" 23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 =" -" 23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3 =" -" 41.2 kJ·mol-1
CO2(g)+H2(g) △H3 =" -" 41.2 kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)。
CH3OCH3(g)+CO2(g)。
该反应的反应热△H =_________。催化反应室中采用300℃的反应温度,理由是 。
(2)已知:反应①在300℃时的化学平衡常数为0.27。该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将(填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为 。
(4)图为绿色电“二甲醚燃料电池”的工作原理示意图。
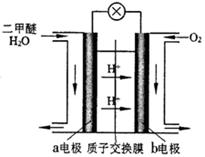
该电池工作时,H+向 极移动(填“正”或“负”);a电极的电极反应式为 。
参考答案:(1)-246.1KJ/mol,提高化学反应速率;(2)逆向
本题解析:
试题分析:(1)①×2+②+③,整理可得3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
△H=2△H 1+△H2 +△H3 =-246.1KJ/mol;由于该反应的正反应是放热反应,所以若要采用很高的温度,反应物的转化率 降低,之所以在催化反应室中采用300℃的反应温度,是为了提高化学反应速率,缩短达到平衡所需要的时间;(2)各种物质的浓度分别是:c(CO)=1mol/L; c(H2)="1.5mol/L;" c(CH3OH)=1mol/L.由于Q=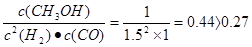 ,所以此时反应将逆向进行;(3)在上述反应过程中制取的物质中除了含有二甲醚外,还含有甲醇、CO、CO2、水蒸气,所以制取流程中二甲醚精制的实验操作名称为蒸馏;(4)在绿色电“二甲醚燃料电池”工作时,H+向负电荷较多的正极极移动;负极a电极的电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+。
,所以此时反应将逆向进行;(3)在上述反应过程中制取的物质中除了含有二甲醚外,还含有甲醇、CO、CO2、水蒸气,所以制取流程中二甲醚精制的实验操作名称为蒸馏;(4)在绿色电“二甲醚燃料电池”工作时,H+向负电荷较多的正极极移动;负极a电极的电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+。
考点:考查盖斯定律的应用、反应热效应的判断、化学反应进行的方向的判断、混合物的分离方法、燃料电池 的电极反应式的书写的知识。
本题难度:困难
4、填空题 (14分)已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好。
(1)硫酸生产中,SO2催化氧化生成SO3,反应混合体系
中SO3的百分含量和温度的关系如右图所示(曲线上
点均为平衡状态)。由图可知:

①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
②若温度为T1时,反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”);
③硫酸厂的SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为 、 ;
④新型氨法烟气脱硫技术是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。其优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为:________(只要求写一种);
(2)汽车尾气(含有烃类、CO、NOx等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。其前半部反应方程式为:
2CO+2NO  2CO2+N2。它的优点是 ;
2CO2+N2。它的优点是 ;
(3)有人设想用图所示装置,运用电化学原理将CO2、SO2转
化为重要化工原料。

①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为
;
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟
从C处获得100 mL 10 mol/L H2SO4,则A处通入烟气(SO2
的体积分数为1%)的速率为 L/min(标准状况)。
参考答案:(14分)
(1)① < ;(1分) 向左;
本题解析:
试题分析:(1)①根据图可判断随温度升高,三氧化硫的百分含量减小,说明升温平衡逆向移动,所以正向是放热反应,△H<0;在恒温、恒压条件下向上述平衡体系中通入氦气,使容器体积增大,各物质浓度均减小,相当于体系减小压强,平衡向左移动;
②若温度为T1时,反应进行到状态D时,三氧化硫的转化率未达平衡状态的转化率,所以反应正向进行,v(正)>v(逆);
③SO2尾气用过量的氨水吸收,先生成亚硫酸铵,再与硫酸反应又生成二氧化硫,化学方程式为SO2+H2O+2NH3 =(NH4)2SO3 、(NH4)2SO3+H2SO4 =(NH4)2SO4+SO2↑+H2O ;
(2)它的优点是使有毒气体转化为无毒气体;
(3)①若A为CO2,B为H2,C为CH3OH,则正极发生还原反应,元素化合价降低,所以是CO2发生还原反应生成甲醇,电极反应式为CO2+6H++6e-= CH3OH+H2O;
②A为SO2,则SO2+2H2O-2e-=H2SO4+2H+,每分钟从C处获得1mol H2SO4,则需要二氧化硫是22.4L(标准状况),SO2的体积分数为1%,所以A处通入烟气的速率是22.4L/min÷1%=2240L/min。
考点:考查化学平衡理论的应用,二氧化硫的吸收,电化学原理的应用及计算
本题难度:困难
5、选择题 近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂.电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
A.乙醇在电池的负极上参加反应
B.1mol?CH3CH2OH被氧化转移6mol电子
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应为4H++O2+4e-→2H2O
参考答案:A.由反应的总方程式可知乙醇被氧化,在负极上失去电子,故A正
本题解析:
本题难度:一般