微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据相关化学原理,下列判断正确的是(???)
A.若生成物的总能量高于反应物的总能量,则该反应是放热反应
B.HX、HY是两种酸,若有反应HX + Y- → X- + HY,则酸性:HX > HY
C.60℃时,NaCl溶液的pH < 7,则溶液呈酸性
D.若原子半径R > M,则原子序数R < M
参考答案:B
本题解析:略
本题难度:一般
2、选择题 下表是相同温度下三种酸的一些数据,下列判断正确的是
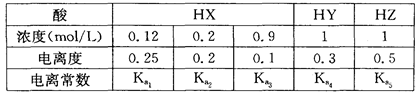
A.在相同温度下,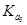 >
> >
>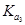
B.室温时,若在NaZ溶液中加水,则 /
/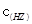 ·
· 的比值变小,若加少量盐酸,则比值变大
的比值变小,若加少量盐酸,则比值变大
C.等物质的量浓度的NaX、NaY和NaZ的混合溶液,则 <
<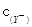 <
<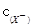
D.在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且 >
>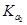 >
>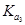 =0.01
=0.01
参考答案:A
本题解析:
试题分析:电离度是弱电解质达到电离平衡时已经电离的电解质分子浓度占电解质分子总浓度的百分比。它不仅以温度有关,还与电解质的浓度有关。电离平衡常数是弱电解质达到电离平衡时电离产生的各种离子浓度的乘积与未电离的电解质分子的浓度的比。它只与温度有关,而与浓度无关。A.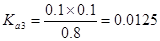 ;
; 本题难度:简单
本题难度:简单
3、选择题 下列图示与对应的叙述相符的是( )
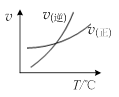

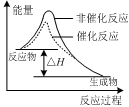
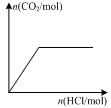
图甲 图乙 图丙 图丁
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B.图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
参考答案:B
本题解析:
试题分析:A、图甲中升高温度逆反应速率增大的程度大于正反应速率增大的程度,平衡向逆反应方向进行,这说明正方应是放热反应,因此该反应的ΔH<0,A不正确;B、醋酸是弱酸,存在电离平衡。盐酸是强酸,完全电离,因此稀释pH相同的醋酸和盐酸溶液,盐酸溶液的pH变化程度大,所以图乙中曲线a对应的是醋酸,B正确;C、图丙中反应物的总能量高于生成物的总能量,因此表示该反应为放热反应,但催化剂只能改变活化能,不能改变反应的焓变,C不正确;D、向Na2CO3溶液中逐滴滴加稀盐酸首先碳酸钠转化为碳酸氢钠,然后碳酸氢钠再与盐酸反应生成氯化钠、水和二氧化碳,与图像不符合,D不正确,答案选B。
考点:考查外界条件对平衡状态、电离平衡的影响,反应热以及碳酸钠与盐酸反应的有关判断
本题难度:一般
4、填空题 (2分)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)==c(M+),而乙同学认为c(A-)与 c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为 同学的说法正确,理由是 。
参考答案:甲;依溶液中的电荷守恒:c(M+)+c(H+)=c(A+)+
本题解析:略
本题难度:一般
5、选择题 取0.2 mol·L—HX溶液与0.2mol·L—NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8(25℃),则下列说法(或关系式)正确的是??? (??? )
A.混合溶液中由水电离出的c(OH一)=1×10—8mol·L-。
B.c(Na+)=c(X一)+c(HX)=0.2 mol·L-
C.c(Na+)一c(X一)=9.9×10-7mol·L-
D.c(OH一)一c(HX)=c(H+)=1×lO一6mol·L一
参考答案:C
本题解析:
试题分析:0.2 mol·L—HX溶液与0.2mol·L—NaOH溶液等体积,二者前后完全反应,混合溶液的pH=8(25℃),说明生成物NaX水解显碱性,则HX为弱酸。A、混合溶液中的OH?都是由水电离出的,所以c(OH一)=1×10-6mol·L-1,错误;B、混合溶液的体积为HX溶液和NaOH溶液的体积和,根据物料守恒可得:c(Na+)=c(X一)+c(HX)=0.1 mol·L-,错误;C、X -发生水解反应:X -+H2O  本题难度:一般
本题难度:一般