微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某同学要配制1.0mol/L的NaOH溶液250mL,提供的仪器有:①漏斗②玻璃棒??③托盘天平(配砝码和镊子)?④药匙??⑤胶头滴管??⑥烧杯
(1)用上述仪器配制溶液时所需的玻璃仪器有______(填序号);还需要的玻璃仪器是______.
(2)由题意可知,你应该称取固体NaOH______g,如果由于称量时间过长,你所配制的NaOH溶液的浓度与要求相比______(填“偏高”、“偏低”或“无影响”).
参考答案:(1)一定规格的容量瓶只能配制相应体积的溶液,容量瓶应选择2
本题解析:
本题难度:一般
2、计算题 (8分)将Na2CO3和NaHCO3混合物19g,充分加热后,收集到1.12L(标准状况)CO2,冷却后将剩余固体溶于水中,配制成300ml溶液。求:
(1)原混合物中NaHCO3的质量。
(2)所配制的溶液的物质的量浓度
参考答案:(1) 8.4g????(2) 0.5mol/L
本题解析:
试题分析:(1)?? 2NaHCO3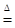 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
2×84?????? 1??? 22.4L
x???????? y??? 1.12L
x=8.4g??? y=0.05mol
(2)m(Na2CO3)=19g-8.4g=10.6g,所以n(Na2CO3)=
本题难度:一般
3、选择题 某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),SO42-的物质的量浓度为6mol·L-1,加入足量铁粉充分反应后(忽略溶液体积的变化),c(Fe2+)为
A.4mol·L-1
B.6mol·L-1
C.8mol·L-1
D.10mol·L-1
参考答案:B
本题解析:
试题分析:根据题意在完全反应后溶液中溶质为FeSO4,c(Fe2+)等于SO42-的物质的量浓度,为6mol·L-1,B正确。
本题难度:一般
4、选择题 将甲苯和甘油以一定比例混合,测得混合物含碳51.3%,那么氧元素的质量分数是( )
A.40%
B.35%
C.30%
D.无法计算
参考答案:甲苯的分子式为C7H8,相对分子质量为92,甘油的分子式为C
本题解析:
本题难度:一般
5、实验题 用18mol/L 浓硫酸配制100 mL 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解 ④ 转移、洗涤 ⑤ 定容、摇匀
回答下列问题
(1)所需浓硫酸的体积是_________,量取浓硫酸所用的量筒的规格是_________
(从下列中选用 A. 10ml B. 20ml C. 50ml D. 100ml)
(2)第③步实验的操作是_________。
(3)第⑤步实验的操作所用到的仪器有_________。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中_________
B. 容量瓶用蒸馏洗涤后残留有少量的水_________
C. 所用过的烧杯、玻璃棒未洗涤_________
D. 定容时俯视溶液的液凹面_________
参考答案:(1)16.7mL;B. 20mL
(2)取一烧杯,先
本题解析:
本题难度:一般