微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为(???)
A.1∶7
B.7∶1
C.7∶8
D.8∶7
参考答案:B
本题解析:参与反应的CuSO4与H2SO4的物质的量分别是x和y。由于铜离子的氧化性强于氢离子的,所以铁首先还原铜离子。因此64x=a,56x+56y=a,解得x︰y=7∶1,答案选B。
本题难度:一般
2、实验题 (16分)实验室为完成某一实验,需用240mL1.0mol/L的稀盐酸,现用11.8mol/L的浓盐酸配制,填空并请回答下列问题:
(1)配制完成某一实验所需1.0mol/L的盐酸溶液,应量取浓盐酸体积为 mL,所用到的玻璃仪器除量筒、烧杯、玻璃棒外还要用到有 、 等。
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) →D。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
F.改用某仪器加水,使溶液凹液面恰好与刻度相切
(3)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响):没有进行A操作 ;C操作时不慎有少量液体溅出容量瓶外 ;定容时俯视_____________。
(4)10.6gNa2CO3与足量所配制的盐酸反应,生成CO2气体在标准状况下的体积是__________升。
参考答案:(1)21.2;胶头滴管,250 mL容量瓶(没指明容量0分
本题解析:
试题分析:(1)根据稀释定律,稀释前后溶质硫酸的物质的量不变,设需要钠元素的体积为V,则:
1mol/L×250mL=11.8mol/L×V,解得:V=21.2mL,配制240mL 1mol?L-1的稀盐酸需要的仪器有:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故还需要的仪器有:胶头滴管,250 mL容量瓶。故答案为:21.2;胶头滴管,250 mL容量瓶;(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓盐酸,在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2-3次,并将洗涤液移入容量瓶,继续注入蒸馏水至液面距离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线水平相切,盖好瓶塞,反复颠倒摇匀,故实验操作顺序为:BCAEFD。故答案为:BCAEF;
(3)没有进行洗涤烧杯,少量HCl沾在烧杯内壁上,移入容量瓶中HCl的物质的量偏小,所配溶液浓度偏低,移液时不慎有少量液体溅出容量瓶外,移入容量瓶中HCl的物质的量偏小,所配溶液浓度偏低,定容时俯视,液面在刻度线以下,溶液的体积偏小,所配溶液的浓度偏高,故答案为:偏低,偏低,偏高.
(4)10.6gNa2CO3的物质的量为10.6/106=0.1mol,盐酸足量,碳酸钠完全反应,根据碳原子守恒可知,生成二氧化碳的物质的量为0.1mol,所以二氧化碳的体积为0.1×22.4=2.24L。
考点:一定物质的量浓度溶液的配制,根据方程式的计算。
本题难度:一般
3、选择题 甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含离子如下表所示,取等质量的三种化合物配制相同体积的溶液,其溶质物质的量浓度:c(甲)>c(乙)>c(丙),则乙物质可能是
阴离子
| OH-、NO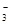 、SO 、SO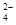
| 阳离子
| NH 、Na+、Mg2+ 、Na+、Mg2+
①MgSO4 ②NaOH ③(NH4)2SO4 ④Mg(NO3)2 ⑤NH4NO3
A.①② B.③④ C.③⑤ D.①⑤
参考答案:C
本题解析:
试题分析:甲、乙、丙均是可溶性强电解质,则OH-只能与Na+组成NaOH,三种化合物不含相同离子,所以甲、乙、丙化合物有两种组合,第一组:NaOH、(NH4)2SO4、Mg(NO3)2;第二组:NaOH、NH4NO3、MgSO4,根据溶质质量相等,溶液体积相等以及物质的量浓度大小判断,相对分子质量:Mr(丙)>Mr(乙)>Mr(甲)。第一组:NaOH相对分子质量为40,(NH4)2SO4相对分子质量为132、Mg(NO3)2相对分子质量为148;第二组:NaOH相对分子质量为40、NH4NO3相对分子质量为80、MgSO4相对分子质量为120,所以乙可能是硫酸铵或硝酸铵,故C项正确。
考点:本题考查离子共存、物质的量浓度的计算。
本题难度:一般
4、选择题 已知3.01×1023个X气体分子的质量为16g,则X气体的摩尔质量是
A.16g
B.32g
C.64g /mol
D.32g /mol
参考答案:D
本题解析:
试题分析:3.01×1023个X气体分子的物质的量= N/NA=(3.01×1023)/= (6.02×1023)=0.5mol,X气体的摩尔质量=m/n=16g/0.5mol=32g/mol,故选D。
考点:考查物质的量的有关计算。
本题难度:一般
5、选择题 过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中有关物质韵物理量正确的是(NA表示阿伏加德罗常数)
?
| 二氧化碳
| 碳酸钠
| 转移的电子
| A
| 1mol
| ?
| NA
| B
| 22.4L
| 1mol
| ?
| C
| ?
| 106 g
| 1mol
| D
| ?
| 106g
| 2NA
参考答案:AC
本题解析:
正确答案:AC
根据过氧化钠与二氧化碳反应的方程式2Na2O2+2CO2=2Na2CO3+O2↑,每有1mol过氧化钠参与反应固体增重28g,转移1mol电子,消耗1mol二氧化碳,A正确。B项气体状态不确定,体积不一定是22.4L,D项转移1mol电子。
本题难度:一般
|
|