微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 请仔细观察两种电池的构造示意图
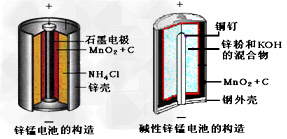
回答下列问题:
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式:__________________
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是____________________
(3)某工厂回收废旧锌锰电池,其工艺流程如下
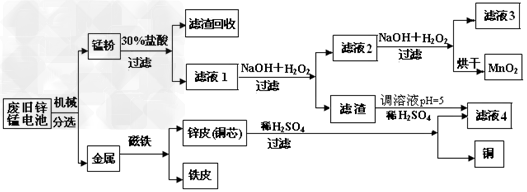
已知:生成氢氧化物的pH如下表

①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2、__________。
②第一次加入H2O2后,调节pH=8.0。目的是_______________。
③试列举滤液4的应用实例____________________。
参考答案:(1)Zn+2OH--2e-=Zn(OH)2
(2)碱
本题解析:
本题难度:一般
2、选择题 “活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是(???)
A.活化分子之间的碰撞不一定都是有效碰撞
B.升高温度,可使单位体积内活化分子增多,反应速率加快
C.对于有气体参加的反应增大压强,可使单位体积内活化分子百分数增加,反应速率加快
D.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
参考答案:C
本题解析:增大压强可使单位体积内活化分子个数增加,但活化分子百分数不变
本题难度:一般
3、选择题 为探究锌与稀盐酸反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断正确的是

A.加入铜粉,v(H2)增大
B.加入NaHSO4固体,v(H2)不变
C.加入水,锌不与水反应,v(H2)不变
D.加入NaCl固体,会增大Cl-浓度,使v(H2)增大
参考答案:A
本题解析:
试题分析:A、加入铜粉,形成锌铜原电池反应,加快了锌与稀盐酸反应速率,v(H2) 增大,故A正确;B、加入NaHSO4固体,氢离子的浓度增大,v(H2)增大,故B错误;C、加入少量水,浓度减小,则v(H2)减小,故C错误;D、锌与稀盐酸反应的实质是锌与氢离子反应,反应速率与Cl-浓度大小无关,故D错误,故选A。
本题难度:简单
4、选择题 升高温度能加快化学反应速率的主要原因是
A.增加活化分子百分数
B.降低活化分子的能量
C.活化分子能量明显增加
D.降低反应所需的能量
参考答案:A
本题解析:考查外界条件对反应速率的影响。升高温度能增大反应物分子中活化分子的百分数,所以反应速率加快,催化剂才能改变活化能,答案选A。
本题难度:一般
5、选择题 用过量铁片与稀盐酸反应,为加快其反应速率而生成氢气的量不变,下列措施中可行的是①以铁屑代替铁片?②用过量锌片代替铁片?③在稀盐酸中加入少量CuSO4溶液④在稀盐酸中加入CH3COONa固体⑤在稀盐酸中加入等物质的量浓度的硫酸⑥在稀盐酸中加入硫酸钾溶液?⑦微热(不考虑HCl的挥发)⑧在稀盐酸中加入NaNO3固体
A.除④外
B.除④⑤⑥⑧外
C.除④⑥外
D.全部都可行
参考答案:B
本题解析:考查外界条件对反应速率的影响。①是增大反应物的接触面积,反应速率增大;锌的金属性强于铁的,可以增大反应速率,且金属过量,生成生物氢气不变;加入硫酸铜后,铁能置换出铜,构成原电池,可以增大反应速率,且金属过量,生成生物氢气不变;④、⑥是降低氢离子的浓度,反应速率降低;⑤增大氢离子的物质的量,生成的氢气增加;升高温度加快反应速率,且金属过量,生成生物氢气不变;⑧中加入硝酸钾得不到氢气,而是生成NO,所以答案选B。
本题难度:一般