微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
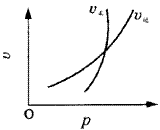
1、选择题 符合图象的反应为( )。
A.N2O3(g) NO2(g)+NO(g)
NO2(g)+NO(g)
B.3NO2(g)+H2O(l) 2HNO3(l)+NO(g)
2HNO3(l)+NO(g)
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
D.CO2(g)+C(s) 2CO(g)
2CO(g)
|
?
参考答案:B
本题解析:此类图象中曲线的意义是外界条件(如温度、压强等)对正、逆反应速率影响的变化趋势及变化幅度。
本题难度:简单
2、实验题 (14分)下表是稀硫酸与某金属反应的实验数据:
实验序号
| 金属
质量/g
| 金属状态
| c(H2SO4)
/mol·L-1
| V(H2SO4)
/mL
| 溶液温度/℃
| 金属消失的时间/s
| 反应前
| 反应后
| 1
| 0.10
| 丝
| 0.5
| 50
| 20
| 34
| 500
| 2
| 0.10
| 粉末
| 0.5
| 50
| 20
| 35
| 50
| 3
| 0.10
| 丝
| 0.7
| 50
| 20
| 36
| 250
| 4
| 0.10
| 丝
| 0.8
| 50
| 20
| 35
| 200
| 5
| 0.10
| 粉末
| 0.8
| 50
| 20
| 36
| 25
| 6
| 0.10
| 丝
| 1.0
| 50
| 20
| 35
| 125
| 7
| 0.10
| 丝
| 1.0
| 50
| 35
| 50
| 50
| 8
| 0.10
| 丝
| 1.1
| 50
| 20
| 34
| 100
| 9
| 0.10
| 丝
| 1.1
| 50
| 30
| 44
| 40
分析上述数据,回答下列问题:
(1)实验4和5表明,?_________对反应速率有影响,?_________?反应速率越快,能表明同一规律的实验还有?_________(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有?_________(填实验序号);
(3)本实验中影响反应速率的其他因素还有?_________?,其实验序号是?_________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
?_________?_________?_________?_________。
参考答案:(1)固体反应物的表面积?表面积越大? 1和2
(2
本题解析:本题考查考生对实验数据的查阅和分析能力,考查考生对反应速率影响因素的理解程度,对实验结果作出合理解释的能力。题目除要求考生分析实验中影响反应速率的因素,根据数据得出有关结论外,还要求考生进一步分析实验结果,推测反应前后溶液温度变化值相近的原因。
为了通过实验进行物质变化规律的探究,往往要控制实验变量,获得可靠的证据和结论。题设提供的9组实验和相应的数据,显示了实验中如何控制变量来揭示某种因素对反应速率的影响。考生通过题目的提示,对比相应的数据,联系所学的知识,不难作答。在9组实验中,反应前后溶液温度
本题难度:一般
3、选择题 某温度下,在固定容积的密闭容器内,可逆反应A(g)+3B(g) 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则(???) 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则(???)
A.平衡向正反应方向移动
B.平衡不发生移动
C.无法判断平衡移动方向
D.C的体积分数减小
参考答案:A
本题解析:以2∶2∶1的物质的量之比再充入A、B、C,相当于压缩体积为原来的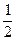 ,平衡向正反应方向移动。 ,平衡向正反应方向移动。
本题难度:简单
4、填空题 某学生为了探究锌与盐酸反应过程中速率变化。在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min)
| 1
| 2
| 3
| 4
| 5
| 氢气体积(mL)
| 50
| 120
| 232
| 290
| 310
(1)在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是 ,
原因为 ;反应速率最小的时间段是 ,
原因为 。(2)在2~3min时间段内,用盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:A .蒸馏水 B .Na2SO4溶液 C. NaNO3溶液 D. CuSO4溶液 E. Na2CO3 溶液, 你认为可行的是 。
参考答案:(11分)(1)2~3 min(1分),因该反应是放热反应,
本题解析:
试题分析:(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、120ml-50ml=70mL、232ml-120ml=112mL、290ml-232ml=68mL、310ml-290ml=20mL,由此可知反应速率最大的时间段为2~3 min。这是由于该反应为放热反应,温度升高,温度对反应速率的影响超过浓度对反应速率的影响,所以反应速率增大。反应速率最小的时间段是4~5min时间段,此时温度虽然较高,但H+浓度小,即浓度对反应速率的影响超过温度对反应速率的影响,因此反应速率降低。
(2)在2~3min时间段内,n(H2)=0.112L÷22.4L/mol==0.005mol,根据2HCl~H2可知,消耗盐酸的物质的量为0.01mol,其浓度为0.01mol÷0.1L=0.1mol/L,则υ(HCl)=0.1mol/L÷1min=0.1 mol/(L?min)。
(3)A、加入蒸馏水,H+浓度减小,反应速率减小,且不减少产生氢气的量,故A正确;B、加入Na2SO4溶液,相当于稀释,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;C、加入NaNO3溶液,在酸性条件下NO3-具有强氧化性,与金属反应得不到氢气,而是生成NO气体,影响生成氢气的量,故C错误;D、加入CuSO4溶液,Zn置换出Cu反应速度增大。但由于消耗锌,从而影响生成氢气的量,故D错误;E、加入Na2CO3溶液,消耗H+,H+浓度减小,影响生成氢气的量,故E错误,所以答案选AB。
考点:考查外界条件对反应速率的影响、影响反应速率条件的实验探究以及反应速率的计算
本题难度:一般
5、选择题 在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最大的是(???) 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最大的是(???)
A.v(A2)=0.8mol·L-1·s-1
B.v(A2)=60mol·L-1·min-1
C.v(AB3)=1.0mol·L-1·s-1
D.v(B2)=1.2mol·L-1·s-1
参考答案:B
本题解析:
试题分析:根据速率比等于系数比,将v(AB3)和v(B2)换算成v(A2)。B中v(A2)=60mol·L-1·min-1
即v(A2)="1" mol·L-1·min-1;C中由v(AB3)=1.0mol·L-1·s-1可得v(A2)="0.5" mol·L-1·s-1;D中由v(B2)=1.2mol·L-1·s-1可得v(A2)="0.4" mol·L-1·s-1。
点评:化学反应速率之比等于化学计量数之比,另外要注意时间的单位。
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772