微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (17分)氢气和氨气都属于无碳清洁能。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2 MH2x(s) △H<0(M表示某种合金)
MH2x(s) △H<0(M表示某种合金)
下图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是_____________

a.T1>T2
b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动
d.在恒温、恒容容器中,达平衡后充入H2,再次平衡后的压强增大
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体。乙装置中a、b为石墨电极,电解过程中,b极质量增加。

①工作过程中,甲装置中d电极上的电极反应式为_____________________________。
②若用该装置电解精炼铜,则b极接____(填“粗铜”或“精铜”);若用该装置给铁制品上镀铜,则____(填“a”或“b”)极可用惰性电极(如Pt电极),若电镀量较大,需要经常补充或更换的是_______。
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质。
已知:N2(g)十3H2(g)  2NH3(g) △H=
2NH3(g) △H=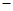 92.4kJ·mol-1
92.4kJ·mol-1
2H2(g)十O2(g)=2H2O(1) △H=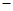 572KJ·mo1-1
572KJ·mo1-1
试写出氨气在氧气中燃烧生成液态水的热化学方程式___________________。
(4)在一定条件下,将lmotN2和3molH2混台于一个10L的密闭容器中发生反应:
N2(g)十3H2(g)  2NH3(g)
2NH3(g)
5min后达到平衡,平衡时氮气的转化率为 。
。
①该反应的平衡常数K=________,(用含 的代数式表示)
的代数式表示)
②从反应开始到平衡时N2的消耗速率v(N2)=____mo1·L-1·min-1。(用含 的代数式表示)
的代数式表示)
参考答案:本题共17分
(1)b(2分)
(2)①O2+4
本题解析:
试题分析:(1)a、温度升高,平衡逆向移动,则吸氢量减少,所以T1<T2,错误;b、增大氢气压强,则增大反应速率,加快氢气的吸收速率,正确;c、M是固体,所以增大M的量,上述平衡不移动,错误;d、在恒温、恒容容器中,达平衡后充入H2,压强增大,平衡正向移动,再次平衡后的压强减小,错误,答案选b;
(2)①甲为原电池,则乙为电解池,反应中b极质量增加,说明b极是阴极,有Cu析出,所以c是原电池负极,d是原电池正极,a是电解池阳极;d极为氧气、二氧化碳发生还原反应,得到电子生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-;
②若用该装置电解精炼铜,则粗铜做阳极,精铜作阴极,b极是阴极,所以b极是精铜;若用该装置给铁制品上镀铜,则铜作阳极,铁作阴极,所以b极一定是铁制品,则a极可用惰性电极;因为铜离子放电析出,需经常补充或更换的是CuSO4溶液;
(3)根据盖斯定律,将所给两个热化学方程式中的氢气消去,可得氨气与氧气反应的热化学方程式,得4NH3(g)+ 3O2(g)=2N2(g)+6H2O(l) △H=-1531.2kJ·mol-1;
(4)① N2(g)十3H2(g)  2NH3(g)
2NH3(g)
开始(mol/L) 0.1 0.3
转化(mol/L) 0.1 0.3
0.3 0.2
0.2
平衡(mol/L)0.1(1- ) 0.3(1-
) 0.3(1- ) 0.2
) 0.2
所以该反应的平衡常数K=(0.2 )2/[0.1(1-
)2/[0.1(1- )] ·[ 0.3(1-
)] ·[ 0.3(1- )]3=400α2/27(1-α)4;
)]3=400α2/27(1-α)4;
②从反应开始到平衡时N2的消耗速率v(N2)=0.1 /5min=0.02α.
/5min=0.02α.
考点:考查条件对平衡的影响,平衡常数、反应速率的计算,电化学反应原理的应用,
本题难度:困难
2、选择题 在2L容器中发生反应N2+3H2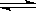 ?2NH3,经一段时间后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol /(L·s),则这段时间为
?2NH3,经一段时间后NH3的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol /(L·s),则这段时间为

A.6 s
B.4 s
C.3 s
D.2 s
参考答案:C
本题解析:略
本题难度:简单
3、实验题 硫代硫酸钠溶液与稀硫酸的反应方程式为:Na2S2O3+H2SO4==Na2SO4+S↓+SO2+H2O,某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。
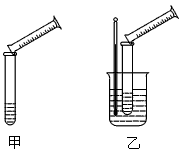
(1)实验目的:装置甲,探究浓度对化学反应速率的影响;
装置乙,探究__________对化学反应速率的影响。
(2)通过甲、乙装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论
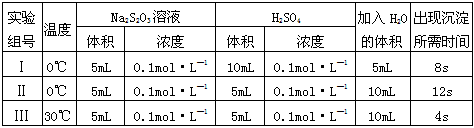
结论1:由Ⅰ和Ⅱ两组数据可知__________________________;
结论2:由Ⅱ和Ⅲ两组数据可知__________________________。
参考答案:(1)温度
(2)结论1:其它条件一定时,反应物浓度越
本题解析:
本题难度:一般
4、选择题 同质量的锌与稀硫酸反应产生氢气,欲使反应速率最大,选择下列组合中的反应条件:①锌粒②锌片③锌粉④98%的浓硫酸⑤15%的稀硫酸⑥20%的稀硫酸⑦加热⑧用冰冷却⑨不断搅拌⑩迅速加入锌片后静置
A.②⑥⑦⑩
B.①④⑧⑩
C.③⑤⑦⑨
D.③⑥⑦⑨
参考答案:D
本题解析:
试题分析:①锌粒②锌片③锌粉,三种锌属锌粉的接触面积最大,化学反应速率最快,①②错误,③正确;④98%的浓硫酸与锌粉反应不生成氢气,错误;⑤15%的稀硫酸⑥20%的稀硫酸,质量分数越大,浓度越大,反应速率越快,⑤错误⑥正确;⑦加热,温度较高,反应速率加快,正确;⑧用冰冷却,温度降低,反应速率减小,错误;⑨不断搅拌,能加快反应速率,正确;⑩迅速加入锌片后静置,化学反应速率较慢,错误;选D。
考点:考查化学反应速率的影响因素。
本题难度:一般
5、选择题 在相同温度下,下列化学反应速率最慢的是( )
A.5mL 0.1mol/L Na2S2O3+5mL 0.1mol/L H2SO44
B.5mL 0.1mol/L Na2S2O3+5mL 0.05mol/L H2SO4
C.10mL 0.1mol/L Na2S2O3+10mL 0.1mol/L H2SO
D.10mL 0.05mol/L Na2S2O3+10mL 0.05mol/L H2SO4
参考答案:D
本题解析:
试题解析:A、混合后Na2S2O3为0.05mol/L,H2SO4为0.05mol/L,B、混合后Na2S2O3为0.05mol/L,H2SO4为0.025mol/L,C、混合后Na2S2O3为0.05mol/L,H2SO4为0.05mol/L,D、混合后Na2S2O3为0.025mol/L,H2SO4为0.025mol/L。对比B、C,Na2S2O3浓度相同,H2SO4浓度相同,故反应速率v(C)=v(B);对比B、A,Na2S2O3浓度相同,B中H2SO4浓度较大,故反应速率v(B)>v(A);对比A、D,H2SO4浓度相同,C中Na2S2O3浓度较大,故反应速率v(A)>v(D);所以反应速率v(B)=v(C)>v(A)>v(D)。
考点:浓度对化学反应速率的影响
本题难度:一般