微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现有浓度均为0.1mol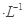 的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(l)①、②、③、④四种溶液中由水电离出的浓度由大到小的顺序是___________________
_____________________________________(填序号)。
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是_________________(填序号)。
(3)将③和④按体积比l:2混合后,溶液的pH>7,则混合液中各离子浓度由大到小的顺序是________________________________________。
(4)已知t℃时,Kw=1×10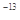 ,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
参考答案:(1)④②③①(2分)
(2)⑥④⑤⑦(2分)
本题解析:
试题分析:(1)④的溶液中盐的水解对水的电离起促进作用,最大;酸碱溶液中对水的电离起抑制作用,但②的H+浓度最小,抑制作用小,①的H+浓度最大,抑制作用最大,所以四种溶液中由水电离出的浓度由大到小的顺序是④②③①;
(2)④中NH4+水解,Cl-不水解,⑤醋酸根离子对NH4+水解起促进作用,⑥硫酸氢铵电离产生的H+对NH4+水解起抑制作用,⑦只是一水合氨的电离产生NH4+,综上所述NH4+浓度由大到小的顺序是⑥④⑤⑦;
(3)将③和④按体积比l:2混合后,所得溶液为同浓度的氯化钠、氯化
本题难度:一般
2、选择题 下列溶液一定呈中性的是(????????)
A.c(H+)=10-7mol/L的溶液
B.pH=7的溶液
C.c(H+)/c(OH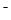 )=10-14的溶液
)=10-14的溶液
D.氨水与氯化铵的混合液中c(NH4+)=c(Cl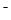 )
)
参考答案:D
本题解析:
正确答案:D
A、B只有在25℃,KW=10―14时,才有可能呈中性,C、一定呈碱性,D、由电荷守恒c(H+)+c(NH4+)=c(OH― )+c(Cl ), c(NH4+)=c(Cl
), c(NH4+)=c(Cl 本题难度:简单
本题难度:简单
3、选择题 现有0.01mol/L的下列溶液:①CH3COOH ②NaHCO3?③NaHSO4?④KOH ⑤H2SO4 按pH由小到大的顺序排列的是 (?? )
A.⑤③①②④
B.③⑤①②④
C.⑤②③①④
D.④②①③⑤
参考答案:A
本题解析:硫酸是二元强酸,硫酸氢钠能电离出氢离子,显强酸性。醋酸是弱酸,碳酸氢钠水解显碱性,而氢氧化钾是强碱,所以pH由小到大的顺序排列的是⑤③①②④,答案选A。
本题难度:一般
4、选择题 常温下,用0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液。当滴入NaOH溶液为20.00 mL时溶液显碱性,溶液中各离子浓度关系正确的是
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.c(Na+) + c(H+)=c(CH3COO-) + c(OH-)
D.c(Na+) + c(OH-)=c(CH3COO-) + c(H+)
参考答案:C
本题解析:
试题分析:由n=c?V可知,CH3COOH、NaOH的物质的量相等,恰好完全中和;生成的CH3COONa是强碱弱酸盐,能完全电离出钠离子和醋酸根离子,而水只能微弱地电离出氢离子和氢氧根离子;钠离子不能水解,而少部分醋酸根离子能水解;醋酸根离子与水电离出的氢离子反应生成醋酸,促进水的电离平衡右移,因此该溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则c(Na+)+c(OH-)>c(CH3COO-)+c(H+),故ABD均错误;根据电荷守恒原理可知,溶液中c(Na+)+c
本题难度:一般
5、填空题 (1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈???????,溶液中c(CH3COO-)??????c(Na+)。(填大于、小于、等于)
(2)将pH=3的硫酸溶液和pH=12的氢氧化钠溶液混和,若使混和后溶液的pH=7,则硫酸溶液和氢氧化钠溶液的体积比是_______
(3)某酸性化工废水中含有浓度约为0.01mol.L-1的Ag+、Pb2+等重金属离子。有关数据如下:
难溶电解质
| AgI
| AgOH
| Ag2S
| PbI2
| Pb(OH)2
| PbS
|
Ksp
| 8.3×10-12
| 5.6×10-8
| 6.3×10-50
| 7.1×10-9
| 1.2×10-15
| 3.4×10-28
(i)在废水排放前,用沉淀法除去这两种离子, 最好加入_________(填字母序号)
A.? Na2S、 B. NaOH 、 C.KI、? D.Ca(OH)2
(ii)某工程师用CaO处理上述废水后Pb2+的浓度为1.2×10-3 ?则此溶液的pH=____。
参考答案:(10分)(1)酸性???大于(2)10:1(3)(i)A;
本题解析:
试题分析:(1)醋酸为弱电解质,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合,醋酸过量,溶液呈酸性,则c(H+)>c(OH-),溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)<c(CH3COO-)。
(2)pH=7溶液呈中性,即反应前n(H+)=n(OH-),故硫酸溶液和氢氧化钠溶液的体积比是10:1。
(3)(i)由表格中的溶度积数据可知,Ag2S和PbS的溶度积最小,则加入Na2S沉淀效果最好,故答案为:A。
(ii)Pb(OH
本题难度:一般
|