微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)我国政府为了消除碘缺乏 病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4====3K2SO4+3I2+3H2O
病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4====3K2SO4+3I2+3H2O
(1)用“双线桥”表示出上述反应中电子转移的方向和数目
________________________________________。
(2)如果反应中转移0.2mol电子,则生成I2的物质的量为_________________。
(3)利用上述反应检验食盐中是否加碘,所需试剂是______________(填下列选项的序号)
失5 ×e-
?
??????①碘水???②KI溶液???③淀粉溶液???④稀硫酸?????⑤AgNO3溶液??
参考答案: 本题解析:略 本题解析:略
本题难度:一般
2、填空题 (12分)Ⅰ.硫在强碱溶液中能发生氧化还原反应:3S+6KOH==K2SO3+2K2S+3H2O。
(1)该反应中,还原产物是________,每生成1 mol K2SO3时,转移电子为________ mol.
(2)该反应中,氧化剂与还原剂的物质的量之比为______________。
Ⅱ. 为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:
KIO3+5KI+3H2SO4===3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________。
(2)当有3 mol I2生成时,有________ mol还原剂被氧化。
(3)当有1 mol氧化剂参与反应时,转移电子的物质的量为________ mol。
参考答案:(12分) Ⅰ. (1)? K2S???? 4.?????(
本题解析:
试题分析:Ⅰ.(1)氧化剂中被还原的元素所生成的产物是还原产物,根据方程式可知,S的化合价从0价降低到-2价,得到电子,被还原,所以K2S是还原产物。而另外部分S元素从0价升高到+4价,所以每生成1 mol K2SO3时,转移电子为4mol。
(2)根据电子的得失守恒可知,氧化剂与还原剂的物质的量之比为2︰1。
Ⅱ.(1)所含元素化合价降低的物质是氧化剂,所以根据方程式可知,碘酸钾中碘元素的化合价从+5价降低到0价,因此碘酸钾是氧化剂。
(2)碘化钾中碘元素的化合价从-1价升高到
本题难度:一般
3、选择题 溴的氧化性介于氯和碘之间。利用这一性质判断,下列说法正确的是(????)
A.Cl—、I—离子加入到含Br—的溶液中,均可以将Br—氧化为Br2
B.将Cl2缓慢通入含有相同物质的量浓度的Br—、I—的混合溶液中,Br—先被氧化
C.湿润的淀粉碘化钾试纸遇到氯气会变蓝色
D.在KBr溶液中加入碘水,发生如下反应:2Br—+I2=2I—+Br2
参考答案:C
本题解析:A项Cl—、I—不具有氧化性,不能将Br—氧化为Br2氧化,A项错误;B项由于I—的还原性强于Br—,所以I—先被氧化;C项Cl2能将碘离子氧化为碘单质,所以能使淀粉变蓝色,C项正确;D项因I2的氧化性弱于Br2不能进行此反应,D项错误。
本题难度:一般
4、填空题 部分弱酸的电离平衡常数如下表:
弱酸
| HCOOH
| HClO
| H2CO3
| H2SO3
| 电离平衡常数
(25℃)
| 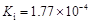
| 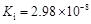
| 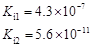
| 
?
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A.2ClO- + H2O + CO2?→ 2HClO + CO32-
B.2HCOOH + CO3?2- → 2HCOO- + H2O + CO2↑
C.H2SO3 + 2HCOO- → 2HCOOH + SO32-
D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式: ?????????????????????? 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是…………………………………( )
A.H2O2既是氧化剂又是还原剂
B.H2O 既不是氧化产物又不是还原产物
C.H2SeO4既是氧化产物又是还原产物
D.氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸,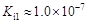 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
HI+ H6TeO6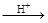 TeO2+ Te+ I2+ H2O TeO2+ Te+ I2+ H2O
(6)若反应中生成的TeO2与Te的物质的量之比为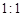 ,试配平上述化学方程式。 ,试配平上述化学方程式。
参考答案:(1)Ki值越大,酸性越强 (2分,合理给分)
(2)
本题解析:
试题分析:(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为.Ki值越大,表示电离出氢离子的程度越大,则酸性越强。
(2)根据电离平衡常数可知A正确的是ClO- + H2O + CO2?→ HClO + HCO 3-,错误。B正确。C.H2SO3 + HCOO- → HCOOH + HSO3- ,错误。D.Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-,正确。
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,生成HCOO
本题难度:一般
5、选择题 下列反应既是离子反应又是氧化还原反应的是(???)
A.大理石与稀盐酸
B.硝酸银溶液与氯化钠溶液
C.锌粒与稀盐酸
D.碳与水蒸气
参考答案:C
本题解析:
试题分析:有离子参加或生成的反应是离子反应,凡是有元素化合价升降的反应都是氧化还原反应。A、B是离子反应,但不是氧化还原反应;D是氧化还原反应,但不是离子反应,答案选C。
点评:该题是中等难度的试题,试题注重基础,主要是考查学生对离子反应和氧化还原反应理解掌握情况,有助于培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确有关的概念和含义。
本题难度:简单
|
|
网站客服QQ: 960335752 - 14613519 - 791315772