微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子可能大量共存的是
A.不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2-
B.能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C.pH= 12的溶液中:Na+、Ba2+、NO3-、Cl-
D.无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+
参考答案:C
本题解析:
试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A、不能使酚酞试液变红的无色溶液显酸性,则CO32-、ClO-、AlO2-均不能大量共存,A错误;B、能与金属铝反应放出氢气的溶液可能显酸性,也可能显碱性,如果显碱性,则NH4+不能大量共存,如果显酸性,在酸性条件下NO3-与铝反应得不到氢气,B错误;C、pH=12的溶液显碱性,Na+、Ba2+、NO3-、Cl-能大量共存,C正确;D、HCO3-与Fe3+不能大量共存,且铁离子在溶液中显棕黄色,D错误,答案选C。
考点:考查离子共存的正误判断
本题难度:一般
2、选择题 下列物质中属于强电解质的是
A.NH3·H2O
B.Cu
C.饱和食盐水
D.醋酸铵
参考答案:D
本题解析:强酸、强碱和大部分的盐属于强电解质,故答案为D;氨水为弱碱,铜是单质,不属于电解质,食盐水为混合物。
本题难度:简单
3、选择题 在溶液中加入过量Na2O2后仍能大量共存的离子组是
A.NH+4、Ba2+、Cl-、NO3-
B.K+、AlO-2、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3-
D.Na+、Cl-、CO32-、SO32-
参考答案:B
本题解析:
试题分析:Na2O2具有强氧化性,加入Na2O2后溶液中存在OH-。A、NH4+与OH-结合生成一水合氨弱碱,不能大量共存,错误;B、彼此都不反应,能大量共存,正确;C、Ca2+、Mg2+、HCO3-与OH-结合生成沉淀,不能大量共存,错误;D、Na2O2具有强氧化性,可以氧化SO32-为SO42-不能大量共存,错误,答案选B。
本题难度:一般
4、选择题 向某溶液中逐滴加入0.5mol/L的NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示 ,则该溶液中可能存在的离子是?
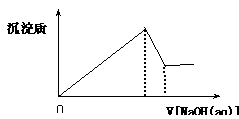
A.只有Mg2+
B.只有Al3+
C.有H+、Mg2+和Al3+
D.有Mg2+和Al3+
参考答案:D
本题解析:
试题分析:根据图像可知,加入氢氧化钠溶液后立即生成沉淀,所以溶液中不存在氢离子,C不正确;当沉淀达到最大值时,继续加入氢氧化钠溶液,沉淀开始溶解,但并没有完全消失,所以溶液中含有的离子时Mg2+和Al3+,答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,难易适中,有利于培养学生分析问题、解决问题的能力。该题的关键是记住常见金属阳离子与氢氧化钠溶液反应原理以及反应特点,然后结合题意灵活运用即可。
本题难度:简单
5、填空题 常温下,浓度均为0.1 mol/L的四种溶液:
①Na2CO3溶液???????? NaHCO3溶液???????????③盐酸????????????????????④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是????????(填编号,下同),溶液中溶质存在电离平衡的是????????????;
(2)比较①、②溶液,PH值较大的是??????????????????;
(3)在溶液④中加入少量NH4Cl固体,此时 的值将??????(填“变小”,“变大”或“不变”);
的值将??????(填“变小”,“变大”或“不变”);
(4)用溶液③滴定V mL溶液④,其滴定曲线如右图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点:
水的电离程度最大的是??????点,理由是;??????
??????????????????????????????????????????????
?????????????????????????????????????????????;
②a点溶液中离子浓度大小关系是???????????????????????????????????????;
③取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,离子浓度大小关系是???????????????????????????。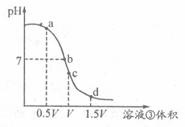
参考答案:
(1)①②(1分)②④(1分)
(2)①(1分
本题解析:略
本题难度:简单