微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于难溶物之间转化的说法中错误的是(?? )
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于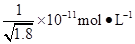
参考答案:A
本题解析:Ksp(AgI)小于Ksp(AgCl),AgI比AgCl更难溶于水,AgCl可以转化为AgI,饱和AgCl溶液中Ag+浓度为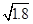 ×10-5 mol·L-1,根据Qc>Ksp,I-的浓度必须不低于
×10-5 mol·L-1,根据Qc>Ksp,I-的浓度必须不低于 本题难度:一般
本题难度:一般
2、计算题 在100mL 0.01mol/L KCl溶液中,加入1mL 0.1mol/L AgNO3溶液,有没有AgCl沉淀析出?(已知AgCl的 Ksp=1.8×10 -10 mol2· L-2)
参考答案:在难溶电解质溶液中,产生沉淀的唯一条件是 Qc>Ksp
本题解析:
本题难度:一般
3、填空题 牙齿表面由一层硬的成分Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq) +OH-(aq)
5Ca2+(aq)+3PO43-(aq) +OH-(aq)
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是_______
???????????????????????????????????。
已知Ca5(PO4)3F的溶解度比上面的矿化物更小,质地更坚固,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因_________________________????。
根据以上原理请你提出另外一种促进矿化的方法_______________________???????。
参考答案:H++OH-=H2O,使平衡向脱矿的方向移动;5Ca2++3
本题解析:本是以生活中牙齿的保护这一实例,给出了一个化学平衡体系,要求通过阅读理解,分析出该题的解题关键是平衡移动就只是,从而将平衡移动原理有有关知识迁移到新情景中,此外,设问中又要求我们进一步根据这一原理,回答保护牙齿的一种方法,这们,可以很好地考查学以致用的能力。
本题难度:一般
4、填空题 【化学与技术】
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题:
 ?
?
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为???????????。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为?????????????。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因???????????。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
A.x ="0.5" ,a =8
B.x =0.5,a = 10
C.x =" 1.5" ,a =8
D.x =" 1.5" ,a = 10
参考答案:(1)氧化还原法
(2)CN-+ClO-=CNO-+C
本题解析:(1)由图可知,将废水中的离子实现上述转化时,利用了氧化还原反应,则主要使用的方法为氧化还原法;
(2)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-,
(3)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为:
3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O。<
本题难度:一般
5、选择题 一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是(?)
Ca2+(aq)+2OH(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是(?)
A.溶液中Ca2+数目减少
B.溶液中c(Ca2+)增大[
C.溶液中pH增大
D.溶液中溶质的质量分数增大
参考答案:A
本题解析:生石灰溶于水可以和水化合生成氢氧化钙,同时放出大量的热。由于溶剂水减少,且溶质增加,同时氢氧化钙的溶解度随温度的升高降低,所以溶液中一定有晶体析出,浓度也会降低,因此答案选A。
本题难度:一般