微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g) H2(g)+I2(g),H2物质的量随时间的变化如图所示。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。
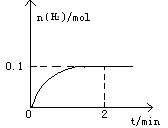
(1)? 0—2 min内的平均反应速率v(HI)=???????????????????????。
该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=???????????????????????。
2HI(g)的平衡常数K=???????????????????????。
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则???????????是原来的2倍。
a.平衡常数??? b.HI的平衡浓度??? c.达到平衡的时间??? d.平衡时H2的体积分数
参考答案:0.1 mol/(L·min)??? 80????? b?(
本题解析:(1)根据图像可知,0—2 min内,氢气的的物质的量增加了0.1mol,则必然消耗HI是0.2mol,使用平均反应速率v(HI)=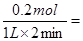 0.1 mol/(L·min) ;平衡时氢气和碘的浓度都是0.1mol/L,而碘化氢的是0.8mol/L,使用该温度下平衡常数K=
0.1 mol/(L·min) ;平衡时氢气和碘的浓度都是0.1mol/L,而碘化氢的是0.8mol/L,使用该温度下平衡常数K=
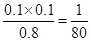 ,所以逆反应的平衡常数是80。
,所以逆反应的平衡常数是80。
(2)平衡常数只与温度有关系,选项a不正确。由于反应前后体积不变,所以该反应是等效的,因此选项b正确,d不正确;浓度增加,反应时间增大,达到平衡的时间减少,选项c不正确,答案选b。
本题难度:一般
2、选择题 ?下列四个数据都表示N2和H2合成氨的反应速率,其中速率代表同一反应中的是???[???? ]
①?V(N2)=0.6mol/(L·min)???????????②?V(NH3)=1.8mol/(L·min)?
③?V(H2)=1.2mol/(L·min)???????????④?V(H2)=0.045mol/(L·s)
A.①②????????????
B.①③????????????
C.③④???????????
D.②④
参考答案:D
本题解析:
本题难度:简单
3、填空题 甲醇汽油是由10%一25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标。甲醇是一种可再生能源,具有广泛的开发和应用前景。
Ⅰ、工业上合成甲醇一般采用下列反应:CO(g)+2 H2(g) CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol,
下表是该反应在不同温度下的化学平衡常数(K):
温度/0C
| 250
| 310
| 350
|
K
| 2.041
| 0.250
| 0.012
?
(1)由表中数据判断△H? a???????0(填“>”、“=”或“<”)。
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)="0.5" mol·L-1,则此时的温度为??????????0C。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
???????浓度mol/L
时间/min
| c(CO)
| c(H2)
| c(CH3OH)
| 0
| 0.8
| 1.6
| 0
| 2
| 0.6
| 1.2
| 0.2
| 4
| 0.3
| 0.6
| 0.5
| 6
| 0.3
| 0.6
| 0.5
?
①反应从2 min到4 min之间,H2的反应速率为????????。
②反应达到平衡时CO的转化率为?????????????。
③反应在第2 min时改变了反应条件,改变的条件可能是????????(填序号)。
A.使用催化剂??? B.降低温度??? C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2 mol H2,发生反应CO(g)+2 H2(g)? ?CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则 ?CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
w1??????w2(填序号)。
A.大于????B.小于????C.等于????D.以上都有可能
Ⅱ、甲醇在化学电源方面也有着重要应用。写出以甲醇为燃料,氢氧化钠溶液为电解质溶液的原电池中负极的电极反应式:?????????????????????????????????????????????。
参考答案:
Ⅰ(1)<(2分)
(2)310(2分)
本题解析:
试题分析:(1)温度升高,K值减小,平衡向左移动,负反应吸热,故正反应放热。
(2)反应结束后,由CO浓度知CO物质的量为1mol。故CO反应量为1mol,剩余CO为1mol,即0.5mol/L,依次推出,H2反应了2mol,剩余H2为4mol,即2mol/L,生成甲醇1mol,即0.5mol/L,此时,反应平衡,K值为0.5/(0.5*2*2)=0.25,为310℃的平衡常数。
(3)①H2物质的量从1.2mol/L,反应成为0.6mol/L,时间经过2分钟,故反应速率为0.3mol/(L*min)
②容积固定,由0.8mol/L,转化到0.3mol/L,转化量为0.5mol/L,转化率为0.5/0.8=0.625
③2~4min内的反应速率大于0~2min 内的反应速率。故排除B,对比CO浓度的变化,排除C。
(4)本题关键是时间。如果时间很短,未充分反应,那么温度高的反应快,CO量少。但如果充分反应后,温度高的,因为平衡向左移动,CO量较多。故都有可能。
(5)其实是甲醇的燃烧反应与二氧化碳被氢氧化钠吸收的和反应。负极失去电子,C由负二价变为正四价,失去6 个电子,已知右边生成CO32-,由电荷守恒,左边OH-,应为8个,水自然补平。但6不是4(O2吸收电子数)的整数倍,故,整体乘2.
本题难度:一般
4、计算题 一定量A、B在2 L的密闭容器中进行反应A(g)+B(g) 2C(g),2 min后,参加反应的各物质的浓度分别为c(A)="0.5" mol ·L-1,c(B)="0.75" mol ·L-1,c(C)="0.5" mol ·L-1,试计算A和B起始的物质的量。 2C(g),2 min后,参加反应的各物质的浓度分别为c(A)="0.5" mol ·L-1,c(B)="0.75" mol ·L-1,c(C)="0.5" mol ·L-1,试计算A和B起始的物质的量。
参考答案:
A(g) + B(g) 本题解析:据题意,已知2 min后参加反应的各物质的浓度,C的起始浓度为0,可求得C的变化浓度。再根据反应方程式可求得A、B的变化浓度,进而可求出A和B的起始浓度和起始的物质的量。 本题解析:据题意,已知2 min后参加反应的各物质的浓度,C的起始浓度为0,可求得C的变化浓度。再根据反应方程式可求得A、B的变化浓度,进而可求出A和B的起始浓度和起始的物质的量。
本题难度:简单
5、填空题 已知: 时,在2L固定容积的密闭容器中充入2mol 时,在2L固定容积的密闭容器中充入2mol 和2mol 和2mol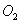 ,10分钟后达到平衡, ,10分钟后达到平衡,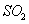 浓度和时间关系如图。 浓度和时间关系如图。
回答下列问题
(1)前5分钟内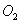 的平均反应速率为?????????? 的平均反应速率为??????????
(2)能说明上述反应一定达到平衡的条件是????????
A.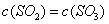
B.气体总物质的量不变
C.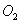 的浓度保持不变 的浓度保持不变
D. ) )
(3)平衡时,02的转化率为?????,此时反应共???????(填“放出”或“吸收”)的热量为????????kJ。该温度下的平衡常数K=????????.
(4)若15分钟时维持温度不变,压缩容器体积,使其体积变为1L,假设在20分钟时达 到新平衡,此时 ,请在图上画出15-25分钟 ,请在图上画出15-25分钟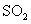 的浓度变化曲线。 的浓度变化曲线。
参考答案:(1)0.06 mol·L-1·min-1???????(2
本题解析:
试题分析:(1)根据图像可知,前5分钟内SO2的浓度减少了1.0mol/L-0.4mol/L=0.6mol,所以根据方程式可知,氧气的浓度就应该减少0.3mol/L,所以氧气的平均反应速率为0.3mol/L÷5min=0.06mol·L-1·min-1。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项C正确平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以选项A不正确。该反应是体积减小的可逆反应,所以当气体的总的物质的量不再发生变化时,可以说明,B正确。D中反应速率的方向相反,但不能满足速率之比是相应的化学计量数之比,不能说明,因此答案选BC。
(3)平衡时SO2的浓度是0.2mol/L,则消耗SO2的浓度是0.8mol/L,则消耗氧气的浓度是0.4mol/L,生成三氧化硫的浓度是0.8mol/L,所以氧气的转化率是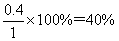 ,此时反应共放出的热量是0.8mol×196kJ/mol=156.8kJ。平衡时氧气的浓度是1mol/L-0.4mol/L=0.6mol/L,所以平衡常数K= ,此时反应共放出的热量是0.8mol×196kJ/mol=156.8kJ。平衡时氧气的浓度是1mol/L-0.4mol/L=0.6mol/L,所以平衡常数K=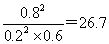 。 。
(4)若15分钟时维持温度不变,压缩容器体积,使其体积变为1L,则相当于是增大压强,平衡向正反应方向移动,SO2的浓度先是瞬间变为0.4mol/L,然后慢慢的降低,但平衡时仍然大于0.2mol/L。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难度较大,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查灵活运用基础知识解决实际问题的能力。有利于调动学生的学习兴趣和学习积极性,提高学生的应试能力和学科素养。
本题难度:困难
|
|