微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
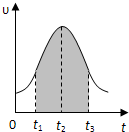
1、简答题 I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.回答如下问题:
(1)该反应的化学方程式:______
(2)0→t2时间段内反应速率增大的原因是:______,
(3)t2→t时间段内反应速率减小的原因是:______,
(4)图中阴影部分“面积”表示t1→t3时间里______.
A.Mn2+物质的量浓度的增大????????????B.Mn2+物质的量的增加
C.SO42-物质的量浓度???????????????????D.MnO4-物质的量浓度的减小
Ⅱ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

?
(1)定性分析:如图甲可观察______,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______.
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为______,实验中需要测量的数据是______
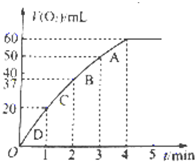
(3)加入0.01mol?MnO2粉末于60mL?H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示.设放出气体的总体积为V?mL.
①放出
V
3
mL气体时所需时间为______min.
②该H2O2溶液的浓度为______
③A、B、C、D各点反应速率快慢的顺序为______>______>______>______.
参考答案:I(1)该反应的反应物是KMnO4和 H2C2O4,高锰酸钾
本题解析:
本题难度:一般
2、填空题 (14分)甲醇被称为21世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。①CH4(g)+H2O (g) CO(g)+3H2(g)??△H1???②CO(g)+2H2(g) CO(g)+3H2(g)??△H1???②CO(g)+2H2(g) CH3OH(g)△H2?将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示: CH3OH(g)△H2?将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示:
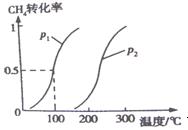
(1)温度不变,缩小体积,增大压强,①的反应速率?????????????(填“增大”.“减小”.“不变”),平衡向???????????方向移动。
(2)反应①的△H1???????0,(填“﹤”“﹦”“﹥”),其平衡常数表达 式为K=???????????????,100℃,压强为p1时平衡常数的值是????????????????。 式为K=???????????????,100℃,压强为p1时平衡常数的值是????????????????。
(3)在压强为0.1Mpa条件下,将a mol CO与3a molH2的混合气体在催化剂作用下进行反应②。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下空格中填入剩余的实验条件数据。
实验编号
| T℃
| n(CO)/n(H2)
| p (Mpa)
| I
| 150
| 1/3
| 0.1
| Ⅱ
| ?
| ?
| 5
| Ⅲ
| 350
| ?
| 5
(4)近几年开发的甲醇燃料电池是采用铂电极,电池中的质子交换膜只允许质子和水分子通过,其工作原理示意图如下:
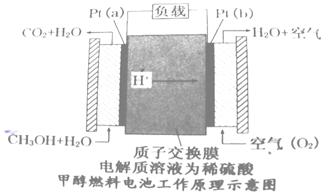
请回答
①Pt(a)电极的电极反应式为???????????????????????????????????????????
②如果该电池工作时电路中通过2mol电子则消耗的CH3OH有??????????mol。
参考答案:(1)增大(1分)??逆反应(或向左)(1分)
(2)
本题解析:略
本题难度:一般
3、选择题 把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中,使它们发生如下反应:3X(g)+Y(g)===nZ(g)+2W(g),在5 min时已经生成0.2 mol W,若测知以Z的浓度变化表示平均反应速率为0.01 mol·L-1·min-1,则上述反应中Z气体的化学计量数n的值是( )
A.4
B.3
C.2
D.1
参考答案:D
本题解析:
试题分析:????????3X(g)??+?? Y(g)??===??? nZ(g)?+?? 2W(g)
起始?????? 0.6mol?????? 0.4mol?????????0????????? 0
变化??????0.3mol?????? 0.1mol???????? 0.1nmol??? 0.2mol
5min剩余???? 0.3mol?????? 0.3mol???????? 0.1nmol???? 0.2mol
根据速率公式可知v(Z)= 本题难度:简单 本题难度:简单
4、填空题 (12分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)≒2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s)
| 0
| 1
| 2
| 3
| 4
| 5
| n(NO)/(mol)
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
?(1)写出该反应的平衡常数表达式:K=???????????????????????。
已知:K(300℃)>K(350℃),该反应是_????????????????。
(2)如图中表示NO2的变化的曲线是?????????????????。
用O2表示从0~2s内该反应的平均速率v=?????????????。
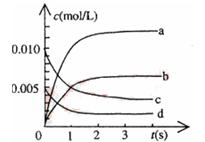
(3)能说明该反应已达到平衡状态的是???????????????????。
a.v(NO2)=2v(O2)???????????? b.容器内压强保持不变
c.v逆?(NO)=2v正 (O2)?????? d.容器内密度保持不变[
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是??????????????。
a.及时分离除NO2气体?????????? b.适当升高温度
c.增大O2的浓度??????????????? d.选择高效催化剂
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
5、选择题 在体积可变的容器中发生反应N2 + 3H2  ?NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是(????) ?NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是(????)
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
D.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多
参考答案:D
本题解析:当增大压强使容器体积缩小时,化学反应速率加快,单位体积内活化分子数增加,有效碰撞次数增多,但活化分子百分数不变。
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772