微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 将符合反应类型的反应的字母填在下列分类方法后的横线上:
A.Fe3O4+4CO 3Fe+4CO2 B.2KMnO4
3Fe+4CO2 B.2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.Zn+H2SO4=ZnSO4+H2↑ D.CaCO3+2HCl=CaCl2+H2O+CO2↑
E.C2H5OH+3O2 2CO2+3H2O F.3Fe+2O2
2CO2+3H2O F.3Fe+2O2 Fe3O4
Fe3O4
G.CuO+H2 Cu+H2O H.HCl+NaOH=H2O+NaCl
Cu+H2O H.HCl+NaOH=H2O+NaCl
(1)属于化合反应的有____。
(2)属于分解反应的有____。
(3)属于复分解反应的有____。
(4)属于置换反应的有____。
参考答案:(1)F
(2)B
(3)DH
(4)CG
本题解析:
本题难度:一般
2、填空题 由于NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须经处理后才能排放。处理方法之一的原理如下:
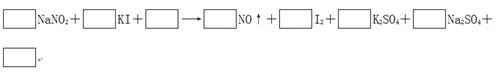 ?
?
(1)请完成并配平该化学方程式。
(2)在上述反应中,若要生成50.8 g I2,则电子转移了________个。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
________________________________________________________________________。
从环保角度来讲,要处理NaNO2,所用物质的________(填“还原性”或“氧化性”)应该比KI更______(填“强”或“弱”)。
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)根据方程式可知,碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,做还原剂。亚硝酸钠中氮元素的化合价从+3价降低到+2价,得到1个电子,做氧化剂。则根据电子守恒可知氧化剂和和还原剂的物质的量之比时1:1。根据原子守恒可知,反应物中还有硫酸生成,生成物还有水生成,则反应的化学方程式是2NaNO2+2KI+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O。
(2)50.8g单质碘的物质的量是50.8g÷254g/mol=0.2mol,所以转移电子的物质的量是
本题难度:一般
3、选择题 ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是[???? ]
2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是[???? ]
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被氧化
D.1 molKClO3参加反应有2mol电子转移
参考答案:AC
本题解析:
试题分析:
选项A,KClO3在反应中得到电子,Cl元素化合价降低;
选项B,ClO2是还原产物;
选项C,
本题难度:简单
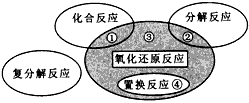
4、选择题 下列化学反应属于图中区域③的是
 [???? ]
[???? ]
A.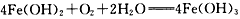
B.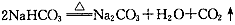
C.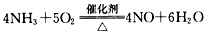
D.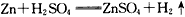
参考答案:C
本题解析:
本题难度:简单
5、选择题 向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的
A.滴加KI溶液时,转移2mol e-时生成1mol白色沉淀
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.通入SO2时,SO2与I2反应,I2作还原剂
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
参考答案:D
本题解析:
试题分析:溶液变为棕色,说明反应中有单质碘生成。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色,进一步验证了碘的存在。因为碘能把SO2氧化生成硫酸和碘化氢。因此硫酸铜和碘化钾反应的化学方程式是2CuSO4+4KI=2CuI↓+I2+2K2SO4,所以转移2mol e-时生成2mol白色沉淀,A不正确;B不正确,体现的是SO2的还原性;C不正确,单质碘是氧化剂;根据氧化还原反应中氧化剂的氧化性强于氧化产物的可知,选项D正确,答案选D。
点评:凡是有元素化合价升降的反应都是氧化还原反应
本题难度:一般