1
请回答下列问题:
(1)上述可逆反应中Q??????0(填“大于”或“小于”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图。试回答:
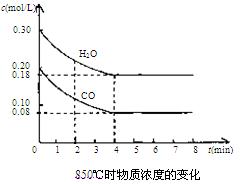
①0~4 min的平均反应速率v(CO)="______" mol/(L·min)
②下列表述能作为该可逆反应达到平衡标志的是__________(填序号)。
A.当混合气体的密度保持不变时
B.当反应消耗0.1molCO(g) 同时也生成0.1molH2O(g)时
C.当CO(g)的质量分数保持不变时
D.当该反应的ΔH不变时
(3)若要加快该反应速率,同时还要提高CO的转化率,可采取的措施为_____(填序号)。
A.增加水蒸气的量?????B.降低温度
C.使用催化剂????????? D.增大压强????????? E.不断移走CO2
参考答案:(8分)
(1)小于(2分)
(2)①0.03(
本题解析:略
本题难度:一般
2、选择题 一定温度下,lmol TaI4和n mol S2在2L的密闭容器中发生反应TaI4(g)+S2(g)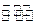 2TaS2(s)+2I2(g),t min后达到平衡,此时生成2a mol I2。下列说法正确的是??????????(???) 2TaS2(s)+2I2(g),t min后达到平衡,此时生成2a mol I2。下列说法正确的是??????????(???)
A.用TaI4表示此反应的反应速率是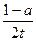 mol/(L·min) mol/(L·min)
B.向平衡后的体系中加入lmol TaS2,平衡向逆反应方向移动
C.给平衡后的体系升温,化学平衡一定移动
D.向平衡后的体系中充入lmol TaI4,v(正)增大,v(逆)减小,平衡正向移动
参考答案:C
本题解析:略
本题难度:简单
3、选择题 氢气既是最理想的能源又是重要的化工原料,用甲烷制氢气是一种廉价的制氢方法。有关的热化学方程式如下:
①CH4(g)+ O2(g) O2(g) CO(g)+2H2(g) ΔH<0 CO(g)+2H2(g) ΔH<0
②CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0 CO(g)+3H2(g) ΔH>0
下列说法不正确的是( )
A.当反应①中v(CH4)正=v(CO)逆时,表明该反应达平衡状态
B.其他条件不变时,增大体系压强,反应①、②中甲烷的转化率均减小
C.使用高效催化剂可以加快反应速率,同时提高CH4的转化率
D.同一容器内同时发生反应①与②时,容器内温度可能保持不变
参考答案:C
本题解析:催化剂只能同等程度地改变化学反应速率,不会改变化学平衡,对甲烷的转化率没有影响,C错。
本题难度:一般
4、选择题 下列能确认化学平衡发生了移动的是( )
A.化学反应速率发生改变
B.有气态物质参加的可逆反应达到平衡后,改变压强
C.由于某一条件的改变,使平衡体系中各组分的浓度发生了不同程度的改变
D.可逆反应达到平衡后,使用催化剂
参考答案:C
本题解析:若正逆反应同等程度加快或同等程度减慢,化学平衡都不移动;若反应物、生成物气体分子数相等,压强改变平衡不移动;使用催化剂时,正逆反应速率同等程度变化,平衡不移动,故正确答案为C。
本题难度:一般
5、选择题 在一定条件下,将1 mol CO和1 mol水蒸气混合后发生如下反应:
CO(气)+H2O(气) CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的?????????????????????????????????? CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的??????????????????????????????????
A.5.75倍
B.11.5倍
C.30.67倍
D.46倍
参考答案:B
本题解析:平衡混合气体与氢气的密度比就等于分子量比。此题的关

混合气体的总的物质的量。根据质量守衡定律,平衡混合气的质量应等于起始的1molCO和1mol水蒸气之和。根据化学方程式反应前后气体的总的物质的量不变,无论化学平衡怎样移动,平衡混合气的总的物质的

为相同条件下H2密度为11.5倍。
本题难度:一般
|