微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一密闭容器中,反应aA(g)?bB(g)达平衡后,保持温度不变,将容器容积增加一倍,当达到新平衡时,B的浓度是原来的60%,则下列说法正确的是( )
A.平衡向正反应方向移动
B.物质A的转化率减小
C.物质B的质量分数减少
D.化学计量数关系a>b
参考答案:aA(气)?bB(气)达平衡后,保持温度不变,将容器体积增加
本题解析:
本题难度:一般
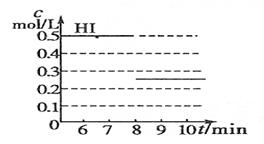
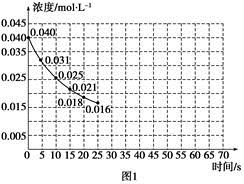
2、填空题 (8分)在某一容积为2L的密闭容器内,加入0.8 mol 的H2和0.6 mol 的I2 ;在一定的条件下发生如下反应:H2(g) + I2(g)  ?2HI(g)??ΔH﹤ 0。反应中各物质的浓度随时间变化情况如图1:
?2HI(g)??ΔH﹤ 0。反应中各物质的浓度随时间变化情况如图1:

(1)根据图1数据,反应开始至达到平衡时,平均速率V(HI)为___________。(精确到小数点后第3位)
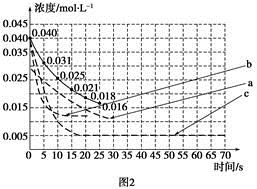
(2)反应达到平衡后,第8分钟时,若升高温度, HI浓度的变化正确的是___________(用图2中a~c的编号回答)。
(3)反应达到平衡后,第8分钟时,若加入I2,?则H2浓度的变化正确的是___________(用图2中d~f的编号回答)。
(4)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图中画出从第8分钟开始向后HI浓度的变化情况。
参考答案:(8分,每空2分)(1) 本题解析:考查反应速率的计算、外界条件对平衡的影响等
本题解析:考查反应速率的计算、外界条件对平衡的影响等
(1)平衡时生成HI是0.5mol/L,所以反应速率是0.5mol/L÷3min=0.167mol/(L·min)。
(2)正反应是放热反应,所以升高温度,平衡向逆反应方向进行,碘化氢的浓度降低,所以答案选c。
(3)若加入I2,?平衡向正反应方向移动,所以H2浓度降低,因此答案选f。
(4)由于反应前后体积不变,所以若把容器的容积扩大一倍,平衡不移动,物质的浓度都变为用来的1/2,所以正确的图像是
 。
。
本题难度:一般
3、简答题 (16分)雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图31-1所示:
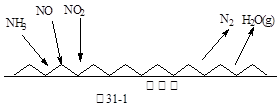 ?
?
①由图31-1可知SCR技术中的氧化剂为:?????????????。
②图31-2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知最佳的催化剂和相应的温度分别为:??????????、?????????????。
③用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图31-3所示,脱氮效果最佳的c(NO2)/c(NO)=????????????????。已知生成1molN2反应放出的热量为QkJ,此时对应的脱氮反应的热化学方程式为????????????????????????????。

(2)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l) H2SO3(l)
H2SO3(l) H+(aq)+HSO3—(aq) ??I
H+(aq)+HSO3—(aq) ??I
HSO3—(aq) H+(aq)+SO32—(aq)????????????????II
H+(aq)+SO32—(aq)????????????????II
Ca(OH)2(s) Ca2+(aq)+2OH—(aq)??????????????III
Ca2+(aq)+2OH—(aq)??????????????III
Ca2+(aq)+SO32—(aq) CaSO3(s)????????????????IV
CaSO3(s)????????????????IV
④步骤II的平衡常数K的表达式为??????????????????。
⑤该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7,则吸收后溶液中的SO32-的浓度。(写出计算过程,保留2位有效数字)
参考答案:(1)① NO、NO2??(2分)??② Mn (2分)?
本题解析:
试题分析:(1)①根据反应前后元素化合价变化可知,氨气中氮元素的化合价从-3价升高到0价,失去电子被氧化做还原剂;氮氧化合中氮元素的化合价降低,得到电子被还原做氧化剂,因此氧化剂是NO、NO2。
②根据图像可知,两种催化剂的脱氮率几乎是相同的,但Mn所在曲线的温度低,所以由图可知最佳的催化剂和相应的温度分别为Mn和200~250℃或范围内间任意温度。
③根据图像可知c(NO2)/c(NO)=1:1是脱氮率最高,由于每生成1molN2反应放出的热量为QkJ,所以此时对应的脱氮反应的热化学方程式为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH=-2QkJ/mol。
2N2(g)+3H2O(g) ΔH=-2QkJ/mol。
(2) ④化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据化学方程式可知,该反应的平衡常数表达式K=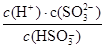 。
。
⑤根据硫酸钙的溶度积常数表达式Ksp(CaSO3)=c(Ca2+)·c(SO32-)可知,c(SO32-)=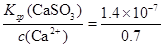 mol/L=2×10-7mol/L。
mol/L=2×10-7mol/L。
本题难度:一般
4、选择题 为了检验新型镍催化剂在不同温度下对苯催化加氢的影响。其他条件相同,定时取样分析成分:
温度/℃
| 85
| 90
| 95
| 100
| 200
| 280
| 300
| 320
| 340
|
苯(mmol)
| 96.05
| 91.30
| 91.55
| 80.85
| 10
| 23.35
| 36.90
| 55.99
| 72.37
|
环己烷
(mmol)
| 3.95
| 8.7
| 8.45
| 19.15
| 90
| 76.65
| 63.10
| 44.01
| 27.63
(采用微型反应装置,压强为0.78 MPa,氢、苯物质的量之比为6.5∶1)
下列说法错误的是
A.随着反应温度的升高,苯的转化率先升高后降低
B.通过改变温度或压强不能使氢气和苯的转化率相同
C.调控压强与氢、苯 物质的量之比可能有利于提高苯的转化率
D.当温度超过280 ℃,苯的转化率迅速下降,可能是因为该反应为吸热的可逆反应
参考答案:D
本题解析:根据表中数据的变化趋势看,AC正确。温度或压强会影响化学平衡,B正确。若正反应吸热,则温度升高有利于提高转化率,即该反应应是放热反应,D不正确。
本题难度:一般
5、填空题 已知CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1 CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
(1)现将0.8 mol CO2和2.4 mol H2充入容积为20 L的密闭容器中发生上述反应,下列说法正确的是__________(填字母序号)。
A.该反应在低温下能自发进行
B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态
C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2
D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适
(2)该反应进行到45 s时达到平衡,此时CO2的转化率为68.75%。下图1中的曲线表示该反应在前25 s内的反应进程中CO2浓度变化。
①若反应延续至70 s。请在图1中用实线画出25 s至70 s的反应进程曲线。
②某化学兴趣小组采用实验对比法分析改变实验条件对该反应进程的影响,每次只改变一个条件,并采集反应进程中CO2的浓度变化,在原有反应进程图像上绘制对应的曲线。实验数据如下表:
实验
编号
| CO2起始
浓度/mol·L-1
| 反应温
度/℃
| 反应压
强/kPa
| 是否加入
催化剂
| A
| 0.030
| 150
| 101
| 否
| B
| 0.040
| 150
| 101
| 否
| C
| 0.040
| 250
| 101
| 是
?
但是该小组负责绘制图线的学生未将曲线(虚线)绘制完整(见图2),也忘记了注明每条曲线所对应改变的条件,请把每个实验编号与图2中对应曲线的字母进行连线。
实验编号 图2中字母
A a
B b
C c
参考答案:(1)AC
(2)①
 本题解析:(1)由于该反应为熵减的放热反应,ΔG=ΔH-TΔS<0,ΔH<0,ΔS<0,所以该反应在低温下能够自发进行,A正确;由于CO2和H2是按系数比加入的,所以CO2的体积分数始终为定值(25%),不能作为达到平衡状态的标志,B错误;该反应为放热反应,温度越高,平衡常数越小,C正确;催化剂能同等程度地改变正逆反应速率,所以Y催化剂更合适,D错误。(2)①达到平衡时 本题解析:(1)由于该反应为熵减的放热反应,ΔG=ΔH-TΔS<0,ΔH<0,ΔS<0,所以该反应在低温下能够自发进行,A正确;由于CO2和H2是按系数比加入的,所以CO2的体积分数始终为定值(25%),不能作为达到平衡状态的标志,B错误;该反应为放热反应,温度越高,平衡常数越小,C正确;催化剂能同等程度地改变正逆反应速率,所以Y催化剂更合适,D错误。(2)①达到平衡时
c(CO2)=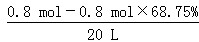 =0.012 5 mol·L-1,画图时应注意45 s到70 s应为一直线。②由于C中温度高且使用催化剂,所以该条件下达到平衡所用时间最短,C—b;A、B比较,A中起始浓度为0.030 mol·L-1对应a曲线;B中起始浓度为0.040 mol·L-1,对应c曲线。 =0.012 5 mol·L-1,画图时应注意45 s到70 s应为一直线。②由于C中温度高且使用催化剂,所以该条件下达到平衡所用时间最短,C—b;A、B比较,A中起始浓度为0.030 mol·L-1对应a曲线;B中起始浓度为0.040 mol·L-1,对应c曲线。
本题难度:一般
|
|