微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 表示下列变化的化学用语正确的是
A.Na2CO3的水解:CO32-+H2O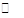 H2CO3+2OH-
H2CO3+2OH-
B.用石墨电极电解硫酸铜溶液:2Cu2++4OH- 2Cu+O2↑+2H2O
2Cu+O2↑+2H2O
C.钢铁发生吸氧腐蚀的正极反应式为:O2 +2H2O+4e- = 4OH-
D.草酸使酸性高锰酸钾溶液褪色:2MnO4—+5C2O42—+16H+=2Mn2++10CO2↑+8H2O
参考答案:C
本题解析:
试题分析:CO32-是弱酸阴离子,分步水解,A项错误;用石墨(惰性电极)电解硫酸铜溶液,阳极是水电离出的OH-放电,所以离子方程式为2Cu2++2H2O 2Cu+O2↑+4H+,B项错误;钢铁发生吸氧腐蚀的正极反应式为:O2 +2H2O+4e- = 4OH-,C项正确;草酸是弱酸,写化学式,D项错误;选C。
2Cu+O2↑+4H+,B项错误;钢铁发生吸氧腐蚀的正极反应式为:O2 +2H2O+4e- = 4OH-,C项正确;草酸是弱酸,写化学式,D项错误;选C。
考点:考查化学用语的正误判断。
本题难度:一般
2、选择题 在10ml 0.1mol/L NaOH溶液中加入等体积、等浓度的CH3COOH溶液,反应后溶液中各粒子的浓度关系错误的是
A.C(Na+)>C(CH3COO-)>C(H+)>C(OH-)
B.C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
C.C(Na+)= C(CH3COO-)+C(CH3COOH)
D.C(Na+)+ C(H+)= C(CH3COO-)+C(OH-)
参考答案:A
本题解析:略
本题难度:一般
3、填空题 (6分)写出下列盐水解的离子方程式:
① CH3COONa
② (NH4)2SO4
③ NaHCO3
参考答案:(6分)(1)①CH3COO-+H2O 本题解析:略
本题解析:略
本题难度:一般
4、选择题 室温下,取0.2mol/L H2 A溶液与xmol/L NaOH溶液等体积混合(忽略混合后溶液体积变化),测得混合溶液的pH=y,下列推断不正确的是
A.当x=0.2,则混合溶液中y可能大于7或小于7
B.当x=0.2,y=1,则混合溶液中:c(H+)=c(A-)+c(OH-)
C.当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D.当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-)
参考答案:C
本题解析:
试题分析:A.当x=0.2,则混合后二者恰好完全反应产生NaHA。若NaHA是强酸的酸式盐或是弱酸的酸式盐,HA-的电离大于其水解作用,则溶液显酸性,y小于7,若NaHA是弱酸的酸式盐,HA-的水解大于其电离作用,则溶液显碱性,y大于7,正确;B.当x=0.2,y=1,反应产生NaHA ,c(NaHA)=0.1mol/L。由于y=1,即c(H+)=0.1mol/L,NaHA是强酸的酸式盐,则根据物料守恒可得混合溶液中:c(H+)= c(A-) +c(OH-),正确;C.当x=0.3,则反应产生的是NaHA、Na2A等浓度的混合溶液。y>7,则混合溶液中离子浓度关系是c(Na+) >c(HA-)>c(A2-)> c(OH-)>c(H+),错误;D。当x=0.4,反应反应产生Na2A。则根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+ c(HA-)+ 2c(A2-)。全部大于部分的和,因此混合溶液中:[c(Na+)+ c(H+)]>2c(A2-),正确。
考点:考查酸碱混合溶液中离子的浓度大小比较的知识。
本题难度:一般
5、选择题 下列各反应的化学方程式中,属于水解反应的是
A.HCO3— + H2O CO32—+ H3O+
CO32—+ H3O+
B.H2O + H2O OH— + H3O+
OH— + H3O+
C.CO2 + H2O H2CO3
H2CO3
D.CO32— +H2O HCO3— + OH—
HCO3— + OH—
参考答案:D
本题解析:
试题分析:A.HCO3— + H2O CO32—+ H3O+ 属于电离过程,不选;B. H2O + H2O
CO32—+ H3O+ 属于电离过程,不选;B. H2O + H2O OH— + H3O+属于电离过程,不选;C.CO2 + H2O
OH— + H3O+属于电离过程,不选;C.CO2 + H2O H2CO3 属于可逆反应,不选;D.CO32— +H2O
H2CO3 属于可逆反应,不选;D.CO32— +H2O HCO3— + OH—属于水解反应,选D。
HCO3— + OH—属于水解反应,选D。
考点:考查水解反应的定义。
本题难度:一般