微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用离子方程式表示) 。
(2)下图是 0.1mol·L-1电解质溶液的pH 随温度变化的图像。
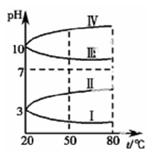
其中符合0.1mol·L-1NH4Al(SO4)2的 pH随温度变化的曲线是 (填写序号),导致 pH 随温度变化的原因是 ;
(3)室温时,向100 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液的pH与所加NaOH溶液体积的关系曲线如图所示:
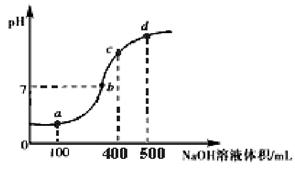
①试分析图中 a、b、c、d 四个点,水的电离程度最大是 点;在 a 点,反应的离子方程式为 。
②下列对 b点时的说法正确的是 。
A.Al3+已经完全沉淀
B.c(Na+)>c(SO42-)>c(NH4+)
C.Al(OH)3部分溶解
D.消耗的 NaOH 溶液体积大于300mL
参考答案:(1)Al3+ +3H2O ![]()
本题解析:
试题分析:(1)NH4Al(SO4)2可作净水剂是因为溶于水时产生的Al3+发生水解生成有吸附性的Al(OH)3,能吸附水中的悬浮物,离子方程式为:Al3+ 91ExAM.org + 3H2O  Al(OH)3 + 3H+(2)NH4Al(SO4)2是强酸弱碱盐,发生水解使得溶液显酸性,升高温度,水解程度增大,溶液酸性增强,pH减小,故符合的图示Ⅰ。(3)①100 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中滴加0.1 mol·L-1 NaOH溶液,先发生的反应是Al3+ + 3OH—=Al(OH)3↓ ,根据NaOH溶液的浓度和体积知道NaOH溶液量还不能完全沉淀Al3+,所以发生的反应是Al3+ + 3OH—=Al(OH)3↓,a、b、c、d四点中a点的Al3+和NH4+浓度最大,水解程度最大,所以水的电离受到的促进程度最大。②b点时如果Al3+没有完全沉淀,Al3+、NH4+水解使得溶液显酸性,现显中性说明Al3+已经完全沉淀,A对;Al3+完全沉淀时NaOH溶液的体积最小要300mL,此时Na+的物质的量比 SO42-多,故c(Na+)>c(SO42-)>c(NH4+),B对;溶液显中性时Al(OH)3不会溶解,Al(OH)3溶于强碱性溶液,不溶于中性和弱碱性溶液,C错;消耗的 NaOH 溶液等于300mL时Al3+已经完全沉淀,溶液中还有NH4+发生水解,溶液显酸性,现溶液显碱性,消耗的 NaOH 溶液体积要大于300mL,D对。
Al(OH)3 + 3H+(2)NH4Al(SO4)2是强酸弱碱盐,发生水解使得溶液显酸性,升高温度,水解程度增大,溶液酸性增强,pH减小,故符合的图示Ⅰ。(3)①100 mL 0.1 mol·L-1 NH4Al(SO4)2溶液中滴加0.1 mol·L-1 NaOH溶液,先发生的反应是Al3+ + 3OH—=Al(OH)3↓ ,根据NaOH溶液的浓度和体积知道NaOH溶液量还不能完全沉淀Al3+,所以发生的反应是Al3+ + 3OH—=Al(OH)3↓,a、b、c、d四点中a点的Al3+和NH4+浓度最大,水解程度最大,所以水的电离受到的促进程度最大。②b点时如果Al3+没有完全沉淀,Al3+、NH4+水解使得溶液显酸性,现显中性说明Al3+已经完全沉淀,A对;Al3+完全沉淀时NaOH溶液的体积最小要300mL,此时Na+的物质的量比 SO42-多,故c(Na+)>c(SO42-)>c(NH4+),B对;溶液显中性时Al(OH)3不会溶解,Al(OH)3溶于强碱性溶液,不溶于中性和弱碱性溶液,C错;消耗的 NaOH 溶液等于300mL时Al3+已经完全沉淀,溶液中还有NH4+发生水解,溶液显酸性,现溶液显碱性,消耗的 NaOH 溶液体积要大于300mL,D对。
考点:盐类水解、化学图像的分析、
本题难度:困难
2、填空题 (14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验
编号
| HA物质的量浓度(mol·L-1)
| NaOH物质的量浓度(mol·L-1)
| 混合溶液的pH
|
甲
| 0.2
| 0.2
| pH=a
|
乙
| c
| 0.2
| pH=7
|
丙
| 0.2
| 0.1
| pH>7
|
丁
| 0.1
| 0.1
| pH=9
(1)不考虑其它组的实验结果,单从甲组情况分析,用a来说明HA是强酸还是弱酸,若a 7,则HA是强酸;若a 7,则HA是弱酸(填<、>、=)。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2 (选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是 。
(3)丙组实验结果分析,HA是 酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
参考答案:(1)a=7;a>7 (2)否;c(A-)=c(N
本题解析:
试题分析:(1)如果HA是强酸,则等体积、等物质的量浓度的HA与NaOH混合,溶液呈中性,如果HA是弱酸,则等体积、等物质的量浓度的HA与NaOH混合,溶液呈酸性。
(2)如果HA为弱酸,与等浓度,等体积的NaOH溶液反应后,溶液呈中性,则需要酸过量,所以c大于0.2,根据电荷守恒:c(H+)+ c(Na+)= c(OH-)+ c(A-),若c(H+)= c(OH-)则c(Na+)= c(A-)。
(3)根据丙可知,酸过量,反应后的溶液呈碱性,说明酸是弱酸。根据电荷守恒:c(H+)+ c(Na+)= c(OH-)+ c(A-),c(H+)< c(OH-),溶质电离出来的离子大于水电离出来的离子,所以溶液中离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+)。
(4)酸和碱等体积等浓度混合,则恰好完全反应,溶液显碱性,说明生成了强碱弱酸盐。溶液中的H+都是由水电离出来的,所以水电离出来的c(H+)= c(OH-)=10-5mol/L。
考点:盐类水解
点评:本题属于盐类水解的综合性习题,是高考中的热点习题。计算水电离出来的离子,要考虑溶液中的H+或OH-是由谁电离出来的,再根据Kw去求。
本题难度:困难
3、选择题 下列物质的水溶液呈碱性的是
A.氯化铵
B.硫酸钾
C.硝酸钠
D.醋酸钠
参考答案:D
本题解析:水溶液呈碱性,要么是碱溶液,要么是强碱弱酸盐。
A不是,氯化铵铵根离子水解,溶液呈酸性。
B不是,强酸强碱盐,中性。
C不是,强酸强碱盐,中性。
D正确,醋酸钠中醋酸根离子水解,溶液呈碱性。
本题难度:一般
4、选择题 设NA为阿伏加德罗常数,下列说法正确的是
A.1L 0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-0.1 NA个
B.1L 0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个
C.2L 0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4 NA个
D.0.1mol/L的H3PO4溶液中,c(H+)∶c(PO43-)<3∶1
参考答案:B
本题解析:
试题分析:A. 1L 0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-因水解小于0.1 NA个,错误;B. 1L 0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个,正确;C. 2L 0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为3.6 NA个,错误;D. 0.1mol/L的H3PO4溶液中,磷酸是三元弱酸,c(H+)∶c(PO43-)>3∶1,错误;选B。
考点:考查阿伏伽德罗常数的计算。
本题难度:一般
5、选择题 下列有关说法正确的是
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C.加热0.1 mol·L-1Na2CO3溶液, 的水解程度和溶液的pH均增大 的水解程度和溶液的pH均增大
D.配制0.01 mol/L的KMnO4 消毒液,所取KMnO4样品受潮,会导致所配溶液浓度偏高
参考答案:C
本题解析:
试题分析:A.海伦外壳附着铜,会和船身的铁及海水形成原电池,铁为负极,腐蚀更快,所以这种说法是错误的,故不选A;B.根据△G=△H-T△S可知,反应在常温下能自发进行,由于该反应的△S <0,则该反应的△H <0,故B错误;C.水解吸热,加热促进水解,溶液的碱性增强,pH会增大,故C正确;D.样品受潮有水,所以称取一定质量的样品,样品中高锰酸钾的质量减少,所配制的溶液的浓度偏大,故D错误。
考点:金属的腐蚀,反应的自发性,外界条件对水解平衡的影响,溶液的配制误差分析。
本题难度:一般
|